摘要:(1)2Na2O2+2SO2=2Na2SO3+O2 . (2)取第1小组实验产物滴入稀盐酸.收集放出的现刺激性气味气体并通入品红溶液中.观察品红溶液是否褪色来判断产物中是否含有Na2SO3. (3)不合理.①B中固体形成溶液加入氯化钡后生成的白色沉淀可能是BaSO3.它被HNO3氧化为BaSO4.使Na2SO4的结论缺少充分的证据,②如果反应后的固体中还残留有过氧化钠.它溶于水后能将亚硫酸根氧化成硫酸根.
网址:http://m.1010jiajiao.com/timu3_id_183372[举报]
有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验.通入SO2气体,将带火星的木条插入试管C中,木条复燃.请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3.
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成.为检验是否有Na2SO4生成,他们设计了如下方案:上述方案是否合理?
查看习题详情和答案>>

(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是
2Na2O2+2SO2═2Na2SO3+O2
2Na2O2+2SO2═2Na2SO3+O2
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3.
取白色固体,加稀硫酸,产生能使品红溶液褪色的气体
取白色固体,加稀硫酸,产生能使品红溶液褪色的气体
.(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成.为检验是否有Na2SO4生成,他们设计了如下方案:上述方案是否合理?
不合理
不合理
.请简要说明两点理由:①稀硝酸能将亚硫酸钡氧化为硫酸钡
稀硝酸能将亚硫酸钡氧化为硫酸钡
;②如果反应后的固体中还残留Na2O2也可将亚硫酸钡氧化为硫酸钡.
如果反应后的固体中还残留Na2O2也可将亚硫酸钡氧化为硫酸钡.
.某同学运用已有的Na2O2和CO2反应的知识进行迁移,认为Na2O2也可和SO2反应,反应式可能为2Na2O2+2SO2=2Na2SO3+O2,为此设计如下一套装置,来验证Na2O2和SO2的反应产物.如图安装仪器,检查装置气密性后添加药品并滴入适量浓硫酸,回答下列问题:

(1)点燃①处酒精灯,不久,观察到①处产生大量气体;③处两通管管壁发热,管内药品的颜色变化为
(2)在反应过程中如何用较简便的操作证明反应产生了O2?
(3)⑥处用排水法收集气体,从什么现象可证明收集的气体中已不含SO2?
(4)待反应结束后,取两通管内少量固体,装入试管中,加水溶解时未产生气体,如何证明产物中有Na2SO3?
(5)待反应结束后,取两通管内少量固体,装入试管中,加入足量盐酸溶液,再加入氯化钡溶液,有白色沉淀生成,试分析产生沉淀的原因.
查看习题详情和答案>>

(1)点燃①处酒精灯,不久,观察到①处产生大量气体;③处两通管管壁发热,管内药品的颜色变化为
淡黄
淡黄
色逐渐变为白
白
色.(2)在反应过程中如何用较简便的操作证明反应产生了O2?
打开④处U型管a处橡皮塞,插入带火星的木条,如果复燃,说明产生了O2
打开④处U型管a处橡皮塞,插入带火星的木条,如果复燃,说明产生了O2
.(3)⑥处用排水法收集气体,从什么现象可证明收集的气体中已不含SO2?
⑤处品红溶液不褪色,说明氧气中不混有二氧化硫
⑤处品红溶液不褪色,说明氧气中不混有二氧化硫
.(4)待反应结束后,取两通管内少量固体,装入试管中,加水溶解时未产生气体,如何证明产物中有Na2SO3?
加入盐酸,若有刺激性气味的气体逸出,则证明产物中含有Na2SO3
加入盐酸,若有刺激性气味的气体逸出,则证明产物中含有Na2SO3
.(5)待反应结束后,取两通管内少量固体,装入试管中,加入足量盐酸溶液,再加入氯化钡溶液,有白色沉淀生成,试分析产生沉淀的原因.
由于过氧化钠有氧化性,反应过程中有部分亚硫酸钠被氧化为Na2SO4和BaCl2反应产生难溶于盐酸的BaSO4
由于过氧化钠有氧化性,反应过程中有部分亚硫酸钠被氧化为Na2SO4和BaCl2反应产生难溶于盐酸的BaSO4
.化学中常用类比的方法可预测许多物质的性质.如根据H2+Cl2=2HCl推测:H2+Br2=2HBr.
但类比是相对的,如根据2Na2O2+2CO2=Na2CO3+O2,类推2Na2O2+2SO2=Na2SO3+O2是错误的,应该是Na2O2+SO2=Na2SO4.
下列各组类比中正确的是( )
但类比是相对的,如根据2Na2O2+2CO2=Na2CO3+O2,类推2Na2O2+2SO2=Na2SO3+O2是错误的,应该是Na2O2+SO2=Na2SO4.
下列各组类比中正确的是( )
查看习题详情和答案>>
化学中用类比的方法可预测许多物质的性质.如根据H2+Cl2=2HCl推测:H2+Br2=2HBr.但类比是相对的,如根据2Na2O2+2CO2=2Na2CO3+O2类推:2Na2O2+2SO2=2Na2SO3+O2是错误的,应该为:Na2O2+SO2=Na2SO4.
(1)下列各组类比中正确的是 (填序号);
A.由NH4Cl
NH3↑+HCl↑ 推测:NH4I
NH3↑+HI↑
B.由2Fe+3Cl2═2FeCl3 推测:2Fe+3Br2═2FeBr3
C.由Na2SO3+2HCl=2NaCl+H2O+SO2↑ 推测:Na2SO3+2HNO3═2NaNO3+H2O+SO2↑
D.由I2易溶于KI溶液 推测:Cl2易溶于NaCl溶液
(2)由氧化铁与盐酸反应生成氯化铁和水,应用有关知识推断写出氧化亚铁与稀硝酸反应的化学方程式 ;
(3)电镀厂向含氰化物的电镀废液中加入漂白粉以消除有毒的CN-的化学方程式为:
CN-+ ClO-+ H2O= HCO3-+ N2+ Cl-,
配平该反应的化学方程式,在空格填上系数;
(4)(CN)2被称为拟卤素,它的阴离子CN-作为配体形成的配合物有重要用途.HgCl2和Hg(CN)2反应可制得Hg2Cl2 和(CN)2,该反应的氧化产物是 .
查看习题详情和答案>>
(1)下列各组类比中正确的是
A.由NH4Cl
| ||
| ||
B.由2Fe+3Cl2═2FeCl3 推测:2Fe+3Br2═2FeBr3
C.由Na2SO3+2HCl=2NaCl+H2O+SO2↑ 推测:Na2SO3+2HNO3═2NaNO3+H2O+SO2↑
D.由I2易溶于KI溶液 推测:Cl2易溶于NaCl溶液
(2)由氧化铁与盐酸反应生成氯化铁和水,应用有关知识推断写出氧化亚铁与稀硝酸反应的化学方程式
(3)电镀厂向含氰化物的电镀废液中加入漂白粉以消除有毒的CN-的化学方程式为:
配平该反应的化学方程式,在空格填上系数;
(4)(CN)2被称为拟卤素,它的阴离子CN-作为配体形成的配合物有重要用途.HgCl2和Hg(CN)2反应可制得Hg2Cl2 和(CN)2,该反应的氧化产物是
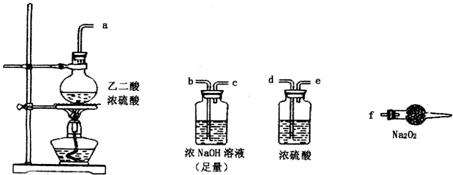
 有两个实验小组的同学探究一氧化碳、二氧化硫与过氧化钠的反应.请回答下列问题:
有两个实验小组的同学探究一氧化碳、二氧化硫与过氧化钠的反应.请回答下列问题:(1)第一小组同学设计如图装置进行实验.通入SO2气体,将带余烬的木条插入试管C中,木条复燃.
甲同学认为Na2O2与SO2反应生成了Na2SO3和O2,则反应的化学方程式为
2Na2O2+2SO2=2Na2SO3+O2
2Na2O2+2SO2=2Na2SO3+O2
.乙同学认为Na2O:与SO2反应除了生成Na2SO3和O2外,还有Na2SO.生成.为检验是否有Na2SO4生成,该同学设计了如下方案:
你认为乙同学的方案是否合理
否
否
(答“是”或“否”);请简要说明两点理由:①
稀HNO3可以把BaSO3氧化为BaSO4
稀HNO3可以把BaSO3氧化为BaSO4
②若反应后的固体有Na2O2残留,溶于水后可把SO32- 氧化为 SO42-
若反应后的固体有Na2O2残留,溶于水后可把SO32- 氧化为 SO42-
.(2)第二小组同学利用下图中的有关装置(固定装置及胶管略去)验证CO气体能否与Na2O2反应.已知:H2C204
| ||
| △ |
Na2CO3
Na2CO3
;验证该产物可选择的试剂是稀H2SO4(或稀HC1)和澄清石灰水
稀H2SO4(或稀HC1)和澄清石灰水
.上述实验中选择的最简单的装置接口连接顺序为abcf
abcf
.