题目内容
 有两个实验小组的同学探究一氧化碳、二氧化硫与过氧化钠的反应.请回答下列问题:
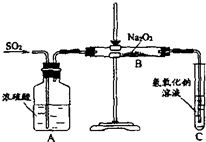
有两个实验小组的同学探究一氧化碳、二氧化硫与过氧化钠的反应.请回答下列问题:(1)第一小组同学设计如图装置进行实验.通入SO2气体,将带余烬的木条插入试管C中,木条复燃.
甲同学认为Na2O2与SO2反应生成了Na2SO3和O2,则反应的化学方程式为
2Na2O2+2SO2=2Na2SO3+O2
2Na2O2+2SO2=2Na2SO3+O2
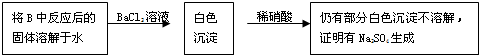
.乙同学认为Na2O:与SO2反应除了生成Na2SO3和O2外,还有Na2SO.生成.为检验是否有Na2SO4生成,该同学设计了如下方案:
你认为乙同学的方案是否合理
否
否
(答“是”或“否”);请简要说明两点理由:①
稀HNO3可以把BaSO3氧化为BaSO4
稀HNO3可以把BaSO3氧化为BaSO4
②若反应后的固体有Na2O2残留,溶于水后可把SO32- 氧化为 SO42-
若反应后的固体有Na2O2残留,溶于水后可把SO32- 氧化为 SO42-
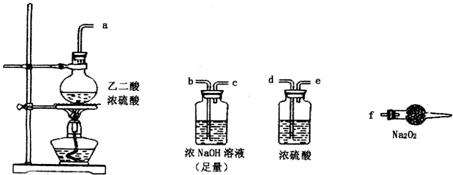
.(2)第二小组同学利用下图中的有关装置(固定装置及胶管略去)验证CO气体能否与Na2O2反应.已知:H2C204
| ||
| △ |
Na2CO3
Na2CO3
;验证该产物可选择的试剂是稀H2SO4(或稀HC1)和澄清石灰水
稀H2SO4(或稀HC1)和澄清石灰水
.上述实验中选择的最简单的装置接口连接顺序为abcf
abcf
.
分析:(1)根据反应物和生成物写出方程式,根据得失电子数相等配平方程式;过氧化钠和硝酸都具有强氧化性,都能把亚硫酸根离子氧化成硫酸根离子;
(2)依据二氧化碳和过氧化钠的反应类推一氧化碳和过氧化钠反应的产物;碳酸盐和稀盐酸或稀硫酸反应生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊;验证CO气体能否与Na2O2反应的,防止二氧化碳的干扰,通入过氧化钠前需要除去二氧化碳.
(2)依据二氧化碳和过氧化钠的反应类推一氧化碳和过氧化钠反应的产物;碳酸盐和稀盐酸或稀硫酸反应生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊;验证CO气体能否与Na2O2反应的,防止二氧化碳的干扰,通入过氧化钠前需要除去二氧化碳.
解答:解:(1)Na2O2与SO2反应生成了Na2SO3和O2,结合得失电子守恒知,该反应方程式为:2Na2O2+2SO2=2Na2SO3+O2,在检验硫酸根离子前要排除亚硫酸根离子的干扰,亚硫酸根离子具有还原性,过氧化钠和硝酸都能把亚硫酸根离子氧化生成硫酸根离子,对硫酸根离子造成干扰,所以乙同学的方案不合理,
故答案为:2Na2O2+2SO2=2Na2SO3+O2;否;
①稀HNO3可以把BaSO3氧化为BaSO4;
②若反应后的固体有Na2O2残留,溶于水后可把SO32- 氧化为 SO42-;
(2)根据二氧化碳和过氧化钠反应生成碳酸钠知,一氧化碳和过氧化钠反应也生成碳酸钠,则一氧化碳和过氧化钠反应的预测产物为Na2CO3,碳酸盐和稀盐酸或稀硫酸反应生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊,所以为检验该产物可选择的试剂是稀H2SO4(或稀HC1)和澄清石灰水;为验证CO气体与Na2O2的反应,防止二氧化碳对其干扰,通入过氧化钠前需要除去二氧化碳,要用氢氧化钠溶液除去二氧化碳所以导气管的连接顺序为:abcf;
故答案为:Na2CO3;稀H2SO4(或稀HC1)和澄清石灰水;abcf.
故答案为:2Na2O2+2SO2=2Na2SO3+O2;否;
①稀HNO3可以把BaSO3氧化为BaSO4;
②若反应后的固体有Na2O2残留,溶于水后可把SO32- 氧化为 SO42-;
(2)根据二氧化碳和过氧化钠反应生成碳酸钠知,一氧化碳和过氧化钠反应也生成碳酸钠,则一氧化碳和过氧化钠反应的预测产物为Na2CO3,碳酸盐和稀盐酸或稀硫酸反应生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊,所以为检验该产物可选择的试剂是稀H2SO4(或稀HC1)和澄清石灰水;为验证CO气体与Na2O2的反应,防止二氧化碳对其干扰,通入过氧化钠前需要除去二氧化碳,要用氢氧化钠溶液除去二氧化碳所以导气管的连接顺序为:abcf;
故答案为:Na2CO3;稀H2SO4(或稀HC1)和澄清石灰水;abcf.
点评:本题以探究过氧化钠与二氧化硫、一氧化碳的反应为依托,考查知识的迁移能力、设计和评价实验方案的能力,难度中等.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案
相关题目



 0
0