网址:http://m.1010jiajiao.com/timu3_id_159269[举报]
(1)比较X、Y、Z的原子半径大小
(2)W与Z形成的单质分别为甲、乙,最简单氢化物分别为丙、丁,下列判断正确的是
a.稳定性:甲>乙,沸点:丙>丁 b.活泼性:甲>乙,沸点:丁>丙
c.稳定性:丙<丁,沸点:甲<乙 d.稳定性:丙>丁,沸点:甲>乙
(3)研究表明:VX2在一定条件下可被还原为晶莹透明的晶体M,其结构中原子的排列为正四面体,请写出M及其2种同素异形体的名称
(4)工业上,将Al2O3、V单质、W单质按物质的量之比1:3:1在高温下反应可制得一种无机非金属材料AlW,该反应的化学方程式为
(5)新型纳米材料ZnFe2Xa可由化合物ZnFe2X4经高温还原制得,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如图所示:
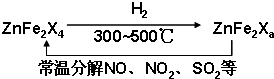
若2mol ZnFe2X a与SO2反应可生成0.75mol S,a=
(6)在t℃时,将a g NH3完全溶于X的常见氢化物,得到V mL溶液,假如该溶液的密度为d g/cm3,质量分数为w,其中含NH4+的物质的量为b mol.下列叙述正确的是
A.溶质的质量分数为w=
| a |
| Vd-a |
B.氨水的物质的量浓度为
| 1000a |
| 35V |
C.溶液中c(OH-)=
| 1000b |
| V |
D.上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w.
甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油.
已知:①CH4(g)+H2O(g)=CO(g)+3H2(g);△H1=+206.2 kJ·mol-1
②CH4(g)+![]() O2(g)=CO(g)+2H2(g);△H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g);△H2=-35.4 kJ·mol-1
③CH4(g)+2H2O(g)=CO2(g)+4H2(g);△H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2(g)反应生成CO(g)和H2(g)的热化学方程式为________.
(2)从原料选择和能源利用角度,比较方法①和②,为合成甲醇,用甲烷制合成气的适宜方法为________(填序号),其原因是________.
(3)合成气中的H2可用于生产NH3,在进入合成塔前常用Cu(NH3)2Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
Cu(NH3)2Ac+CO+NH3![]() [Cu(NH3)3]Ac·CO;△H<0
[Cu(NH3)3]Ac·CO;△H<0
Cu(NH3)2Ac溶液吸收CO的适宜生产条件应是________.
(4)将CH4设计成燃料电池,其利用率更高,装置示意如下图(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.
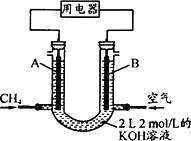
①O<V≤44.8 L时,电池总反应方程式为________;
②44.8 L<V≤89.6 L时,负极电极反应为________;
③V=67.2 L时,溶液中离子浓度大小关系为________.
甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油.
已知:①CH4(g)+H2O(g)=CO(g)+3H2(g);△H1=+206.2 kJ·mol-1
②CH4(g)+![]() O2(g)=CO(g)+2H2(g);△H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g);△H2=-35.4 kJ·mol-1
③CH4(g)+2H2O(g)=CO2(g)+4H2(g);△H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2(g)反应生成CO(g)和H2(g)的热化学方程式为________.
(2)从原料选择和能源利用角度,比较方法①和②,为合成甲醇,用甲烷制合成气的适宜方法为________(填序号),其原因是________.
(3)合成气中的H2可用于生产NH3,在进入合成塔前常用Cu(NH3)2Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
Cu(NH3)2Ac+CO+NH3![]() [Cu(NH3)3]Ac·CO;△H<0
[Cu(NH3)3]Ac·CO;△H<0
Cu(NH3)2Ac溶液吸收CO的适宜生产条件应是________.
(4)将CH4设计成燃料电池,其利用率更高,装置示意如下图(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积V L.
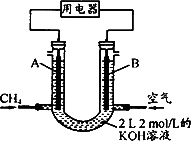
①O<V≤44.8 L时,电池总反应方程式为________;
②44.8 L<V≤89.6 L时,负极电极反应为________;
③V=67.2 L时,溶液中离子浓度大小关系为________.
甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油。
已知:①CH4 (g) + H2O (g)= CO (g)+3H2 (g) △H1=+206.2kJ·mol-1
② CH4(g)+ O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
③CH4 (g) + 2H2O (g) =CO2 (g) +4H2 (g) △H3="+165.0" kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为 。
(2)从原料选择和能源利用角度,比较方法①和②,为合成甲醇,用甲烷制合成气的适宜方法为 (填序号),其原因是 。
(3)合成气中的H2可用于生产NH3,在进入合成塔前常用Cu(NH3)2Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
Cu(NH3)2Ac + CO + NH3 [Cu(NH3)3]Ac·CO △H<0
[Cu(NH3)3]Ac·CO △H<0
Cu(NH3)2Ac溶液吸收CO的适宜生产条件应是 。
(4)将CH4设计成燃料电池,其利用率更高,装置示意如右图(A、B为多孔性碳棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL。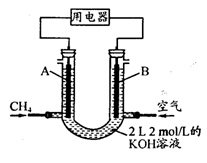
① 0<V≤44.8 L时,电池总反应方程式为 ;
② 44.8 L<V≤89.6 L时,负极电极反应为 ;
③ V="67.2" L时,溶液中离子浓度大小关系为 。
已知:①CH4 (g) + H2O (g)= CO (g)+3H2 (g) △H1=+206.2kJ·mol-1
② CH4(g)+
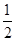 O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1③CH4 (g) + 2H2O (g) =CO2 (g) +4H2 (g) △H3="+165.0" kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为 。
(2)从原料选择和能源利用角度,比较方法①和②,为合成甲醇,用甲烷制合成气的适宜方法为 (填序号),其原因是 。
(3)合成气中的H2可用于生产NH3,在进入合成塔前常用Cu(NH3)2Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
Cu(NH3)2Ac + CO + NH3
 [Cu(NH3)3]Ac·CO △H<0
[Cu(NH3)3]Ac·CO △H<0Cu(NH3)2Ac溶液吸收CO的适宜生产条件应是 。
(4)将CH4设计成燃料电池,其利用率更高,装置示意如右图(A、B为多孔性碳棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL。
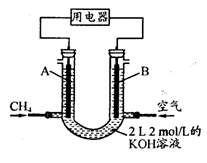
① 0<V≤44.8 L时,电池总反应方程式为 ;
② 44.8 L<V≤89.6 L时,负极电极反应为 ;
③ V="67.2" L时,溶液中离子浓度大小关系为 。