摘要:23.C<D<B<A .B>A>C>D
网址:http://m.1010jiajiao.com/timu3_id_154341[举报]
A,B,C,D四种非金属元素A,B,C,D四种非金属元素.A,B在反应中各结合一个电子形成稳定结构,放出的能量B>A;氢化物的稳定性HC<HA;原子序数C<D,其稳定结构的核外电子数相等,则这四种元素的非金属性由强到弱的顺序是
- A.A,B,C,D
- B.B,A,D,C
- C.A,B,D,C
- D.B,A,C,D
A,B,C,D四种非金属元素.A,B在反应中各结合一个电子形成稳定结构,放出的能量B>A;氢化物的稳定性HC<HA;原子序数C<D,其稳定结构的核外电子数相等,则这四种元素的非金属性由强到弱的顺序是
[ ]
A.A,B,C,D
B.B,A,D,C
C.A,B,D,C
D.B,A,C,D
A、B、C、D、E、F、G全为短周期元素,它们在中学常见化合物中显示的部分化合价及原子、离子半径从大到小的序号如下:(注:半径按①、②、③…的顺序依次减小)
(1)用电子式表示BA2的形成过程
 .
.
(2)写出F的最高价氧化物对应的水化物和G的最高价氧化物对应的水化物反应的离子方程式
(3)请设计实验比较B、F的活动性强弱.
查看习题详情和答案>>
| 元素 性质 |
A | B | C | D | E | F | G |
| 化合价 | +1、+5、+7 | 只有+2 | +4 | -3、+2、+4、+5 | 只有-1 | 只有+3 | 只有+1 |
| 原子半径 | ⑤ | ② | ④ | ⑥ | ⑦ | ③ | ① |
| 离子半径 | ① | ⑤ | 无离子 | ② | ③ | ⑥ | ④ |


(2)写出F的最高价氧化物对应的水化物和G的最高价氧化物对应的水化物反应的离子方程式
Al(OH)3+OH-═AlO2-+2H2O.
Al(OH)3+OH-═AlO2-+2H2O.
.(3)请设计实验比较B、F的活动性强弱.
| 元素 | 实验设计 | 现象 | 结论 |
| B | 活动性:B F (填“>”、“<”或“=”) | ||
| F |
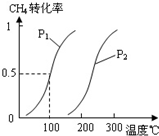 A、B、C、D、E、W均为短周期元素,原子序数依次增大.回答下列问题:
A、B、C、D、E、W均为短周期元素,原子序数依次增大.回答下列问题:(1)E单质为双原子分子,气体E的密度3.17g.L-1(标准状况),写出用石灰水吸收E反应的离子方程式:
Cl2+2OH-=Cl-+ClO-+2H2O
Cl2+2OH-=Cl-+ClO-+2H2O
(2)由A、B、D元素原子组成的化合物CH4和H2O在一定条件下发生反应:CH4(g)+H2O(g)CO(g)+3H2(g).将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),达到平衡时,CH4的转化率与温度、压强的关系如图.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为
0.0030mol?L-1?min-1
0.0030mol?L-1?min-1
.②图中的P1
<
<
P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4
2.25×10-4
.③在其它条件不变的情况下降低温度,逆反应速率将
减小
减小
(填“增大”、“减小”或“不变”).(3)由A、C、D元素原子组成的化合物N2H4和H2O2有广泛的用途.
①N2H4(肼)一空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的氢氧化钾溶液.电池放电时,负极的电极反应式为
N2H4+4OH-=N2↑+4H2O+4e-
N2H4+4OH-=N2↑+4H2O+4e-
.②已知:16g液态N2H4(肼)与足量过氧化氢反应生成氮气和水蒸气,放出320.75KJ的热量.
H2O(1)=H2O(g)△H=+44kJ?mol-1
2H2O2(1)=2H2O(1)+O2(g)△H=-196.4kJ?mol-1
写出N2H4(肼)与氧气反应的热化学方程式为
N2H4(1)+O2(g)=N2(g)+2H2O(1)△H=-621.1kJ?mol-1
或N2H4(1)+O2(g)=N2+2H2O(g)△H=-533.1kJ?mol-1
或N2H4(1)+O2(g)=N2+2H2O(g)△H=-533.1kJ?mol-1
N2H4(1)+O2(g)=N2(g)+2H2O(1)△H=-621.1kJ?mol-1
或N2H4(1)+O2(g)=N2+2H2O(g)△H=-533.1kJ?mol-1
.或N2H4(1)+O2(g)=N2+2H2O(g)△H=-533.1kJ?mol-1
A、B、C、D、E、F六种短周期元素的原子序数依次增大,已知:①A原子核内只有1个质子;②B原子最外层电子数是次外层电子数的2倍;③C原子最外层电子数比次外层电子数多4个;④D原子的次外层电子数是最外层电子数的8倍;⑤E单质既能和盐酸反应又能和烧碱反应;⑥F与C同主族.用化学符号或化学用语回答下列问题:
(1)用电子式表示下列物质A2C2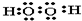
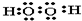 ,DCA
,DCA
 ;
;
(2)用电子式表示D与F形成化合物的过程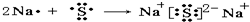
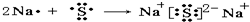 ;
;
(3)用“化学式”和“<或>”比较:A与C、A与F形成化合物的稳定性
(4)写出E与烧碱反应的离子方程式
查看习题详情和答案>>
(1)用电子式表示下列物质A2C2
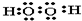
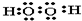


(2)用电子式表示D与F形成化合物的过程
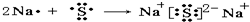
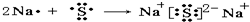
(3)用“化学式”和“<或>”比较:A与C、A与F形成化合物的稳定性
H2O>H2S
H2O>H2S
;沸点的高低H2O>H2S
H2O>H2S
,沸点高低的原因H2O分子间存在氢键
H2O分子间存在氢键
;(4)写出E与烧碱反应的离子方程式
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.