题目内容
A,B,C,D四种非金属元素A,B,C,D四种非金属元素.A,B在反应中各结合一个电子形成稳定结构,放出的能量B>A;氢化物的稳定性HC<HA;原子序数C<D,其稳定结构的核外电子数相等,则这四种元素的非金属性由强到弱的顺序是
- A.A,B,C,D
- B.B,A,D,C
- C.A,B,D,C
- D.B,A,C,D
B
因A,B各结合一个电子形成稳定结构,放出的能量B>A,则非金属性B>A;由氢化物稳定性知非金属性A>C;又因C,D稳定结构的核外电子数相等,但原子序数C<D,可知C,D同周期,且D在C之后,故非金属性D>C导解:因A,B各结合一个电子形成稳定结构,放出的能量B>A,则非金属性B>A;由氢化物稳定性知非金属性A>C;又因C,D稳定结构的核外电子数相等,但原子序数C<D,可知C,D同周期,且D在C之后,故非金属性D>C.故非金属由强到弱只有B符合.
因A,B各结合一个电子形成稳定结构,放出的能量B>A,则非金属性B>A;由氢化物稳定性知非金属性A>C;又因C,D稳定结构的核外电子数相等,但原子序数C<D,可知C,D同周期,且D在C之后,故非金属性D>C导解:因A,B各结合一个电子形成稳定结构,放出的能量B>A,则非金属性B>A;由氢化物稳定性知非金属性A>C;又因C,D稳定结构的核外电子数相等,但原子序数C<D,可知C,D同周期,且D在C之后,故非金属性D>C.故非金属由强到弱只有B符合.

练习册系列答案
相关题目
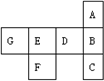 (2010?卢湾区二模)“椅子形状”的图包含了元素周期表前四周期的部分元素,其中A、B、C、D四种元素原子序数之和为77.
(2010?卢湾区二模)“椅子形状”的图包含了元素周期表前四周期的部分元素,其中A、B、C、D四种元素原子序数之和为77.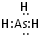
 ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“


 ,判断其中的化学键的类型
,判断其中的化学键的类型