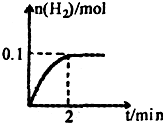网址:http://m.1010jiajiao.com/timu3_id_153222[举报]
(1)下表是硝酸与某种金属M在某些条件下反应所得还原产物的关系:
| 硝酸 | 硝酸浓度大于10mol/L | 硝酸浓度为6.6~10mol/L、加热 | 硝酸浓度为6.6~10mol/L |
| 还原产物 | NO2 | NO2 | NO2 |
| 硝酸 | 硝酸浓度为0.1~6.6mol/L、加热 | 硝酸浓度0.1~6.6mol/L | 硝酸浓度0.1mol/L |
| 还原产物 | NO | NO2、N2 | NH4NO3 |
(2)以氨作为燃料的固体氧化物(含 有02-)燃料电池,具有全固态 结构、能量效率高、无污染等特 点,另外氨气含氢量高,不含碳,易液化,方便运输和贮存,是很 好的氢源载体.其工作原理如图1 所示,
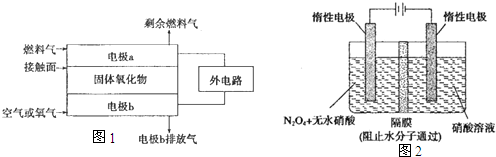
①该电池工作时的总反应为
②固体氧化物作为电池工作的电解质,O2-移动方向为
③该电池工作时,在接触面上发生的电极反应为
(3)N2O5是一种新型硝化剂,其性质和制备 受到人们的关注.如图2所示装置可用于制备N2O5,写出在电解池中生成N205 的电极反应式
(16分)钯(Pd)的性质与铂相似。工业上从废催化剂(主要成分是钯和活性炭,还含有少量铁、锌)中回收钯,采用如下流程: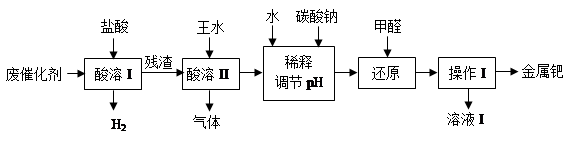
请回答下列问题:
(1)酸溶I的目的是__________________________________。
(2)①酸溶Ⅱ时残渣与王水在加热条件发生的主要反应是:
3Pd +12HCl + 2HNO3  3H2PdCl4 + 2NO↑+ 4H2O
3H2PdCl4 + 2NO↑+ 4H2O
写出催化剂中另一主要成分与浓硝酸反应的化学方程式:_________________。
②酸溶Ⅱ需控制温度不宜过高,除了控制一定反应速率外,其原因可能还有
_____________________________。
③若用足量的烧碱吸收气体,请写出吸收后溶液中含有的溶质的化学式:NaOH、NaNO2、___________、___________。
(3)使用甲醛还原钯的化合物时,溶液须保持碱性,否则会造成甲醛的额外损耗,原因是_______________________________________。
(4)操作I的名称是_______________,溶液I可能含有的有机离子为________________。
(5)有人提出,在进行酸溶前最好先将废催化剂在700℃下进行灼烧,同时不断通入空气,
其目的是______________________________________________________。
(16分)钯(Pd)的性质与铂相似。工业上从废催化剂(主要成分是钯和活性炭,还含有少量铁、锌)中回收钯,采用如下流程:

请回答下列问题:
(1)酸溶I的目的是__________________________________。
(2)①酸溶Ⅱ时残渣与王水在加热条件发生的主要反应是:
3Pd
+12HCl + 2HNO3  3H2PdCl4
+ 2NO↑+ 4H2O
3H2PdCl4
+ 2NO↑+ 4H2O
写出催化剂中另一主要成分与浓硝酸反应的化学方程式:_________________。
②酸溶Ⅱ需控制温度不宜过高,除了控制一定反应速率外,其原因可能还有
_____________________________。
③若用足量的烧碱吸收气体,请写出吸收后溶液中含有的溶质的化学式:NaOH、NaNO2、___________、___________。
(3)使用甲醛还原钯的化合物时,溶液须保持碱性,否则会造成甲醛的额外损耗,原因是_______________________________________。
(4)操作I的名称是_______________,溶液I可能含有的有机离子为________________。
(5)有人提出,在进行酸溶前最好先将废催化剂在700℃下进行灼烧,同时不断通入空气,
其目的是______________________________________________________。
查看习题详情和答案>>
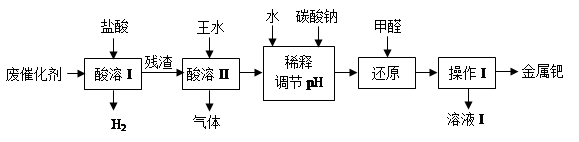
请回答下列问题:
(1)酸溶I的目的是__________________________________。
(2)①酸溶Ⅱ时残渣与王水在加热条件发生的主要反应是:
3Pd +12HCl + 2HNO3
 3H2PdCl4 + 2NO↑+ 4H2O
3H2PdCl4 + 2NO↑+ 4H2O写出催化剂中另一主要成分与浓硝酸反应的化学方程式:_________________。
②酸溶Ⅱ需控制温度不宜过高,除了控制一定反应速率外,其原因可能还有
_____________________________。
③若用足量的烧碱吸收气体,请写出吸收后溶液中含有的溶质的化学式:NaOH、NaNO2、___________、___________。
(3)使用甲醛还原钯的化合物时,溶液须保持碱性,否则会造成甲醛的额外损耗,原因是_______________________________________。
(4)操作I的名称是_______________,溶液I可能含有的有机离子为________________。
(5)有人提出,在进行酸溶前最好先将废催化剂在700℃下进行灼烧,同时不断通入空气,
其目的是______________________________________________________。
Ⅰ.SO2+2H2O+I2═H2SO4+2HI
Ⅱ.2HI?H2+I2
Ⅲ.2H2SO4═2SO2+O2+2H2O
(1)整个过程中SO2、I2的作用是______.
(2)一定温度下,向1L密闭容器中加入1molHI(g),发生反应Ⅱ,生成的
I2为气体,H2物质的量随时间的变化如图所示.0-2min内的平均反应速率v(HI)=______,能作为该反应达到平衡状态判断依据的是______.
①n(H2)=n(I2)
②压强不再变化
③气体密度不再变化
④2个H-I断裂的同时,有1个H-H断裂
⑤各组分浓度保持不变
⑥c(HI):c(H2):c(I2)=2:1:1
已知有关键能数据:I2-151kJ/mol、H2-436kJ/mol、HI-298kJ/mol,则分解0.2molHI时的能量变化是______(填“吸收”或“放出”)______kJ的热量.
(3)实验室用Zn和硫酸制取H2,为了加快反应速率,下列措施不可行的是(填序号)______.
a.加入浓硝酸b.加入少量CuSO4固体c.用粗锌代替纯锌d.加热e.把锌粒制成锌粉f.用98.3%浓硫酸.