题目内容
(2013?保定一模)已知氮元素有许多化合价,其化合价有-3、0、+1、+2、+3、+4、+5
(1)下表是硝酸与某种金属M在某些条件下反应所得还原产物的关系:
通过分析上表可得出的结论是:当硝酸与金属M反应时
(2)以氨作为燃料的固体氧化物(含 有02-)燃料电池,具有全固态 结构、能量效率高、无污染等特 点,另外氨气含氢量高,不含碳,易液化,方便运输和贮存,是很 好的氢源载体.其工作原理如图1 所示,
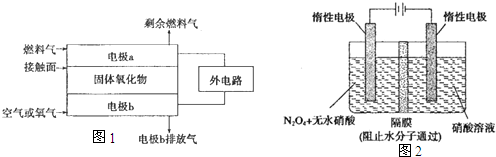
①该电池工作时的总反应为
②固体氧化物作为电池工作的电解质,O2-移动方向为
③该电池工作时,在接触面上发生的电极反应为
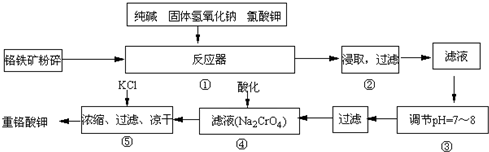
(3)N2O5是一种新型硝化剂,其性质和制备 受到人们的关注.如图2所示装置可用于制备N2O5,写出在电解池中生成N205 的电极反应式
(1)下表是硝酸与某种金属M在某些条件下反应所得还原产物的关系:
| 硝酸 | 硝酸浓度大于10mol/L | 硝酸浓度为6.6~10mol/L、加热 | 硝酸浓度为6.6~10mol/L |
| 还原产物 | NO2 | NO2 | NO2 |
| 硝酸 | 硝酸浓度为0.1~6.6mol/L、加热 | 硝酸浓度0.1~6.6mol/L | 硝酸浓度0.1mol/L |
| 还原产物 | NO | NO2、N2 | NH4NO3 |
硝酸浓度或温度不同,硝酸的含有产物不同
硝酸浓度或温度不同,硝酸的含有产物不同
,金属锌与某浓度的硝酸反应时,无气体产生,则此化学反应中被还原的硝酸与 参加反应的硝酸物质的量之比是1:10
1:10
.(2)以氨作为燃料的固体氧化物(含 有02-)燃料电池,具有全固态 结构、能量效率高、无污染等特 点,另外氨气含氢量高,不含碳,易液化,方便运输和贮存,是很 好的氢源载体.其工作原理如图1 所示,

①该电池工作时的总反应为
2NH3+3O2=N2+6H2O
2NH3+3O2=N2+6H2O
②固体氧化物作为电池工作的电解质,O2-移动方向为
由电极b向电极a移动
由电极b向电极a移动
(选填“由电极a向电极b”或“由电极b向电极a”).③该电池工作时,在接触面上发生的电极反应为
2NH3+3O 2--6e-=N2+3H2O
2NH3+3O 2--6e-=N2+3H2O
.(3)N2O5是一种新型硝化剂,其性质和制备 受到人们的关注.如图2所示装置可用于制备N2O5,写出在电解池中生成N205 的电极反应式
N204+2HNO3-2e-=2N205+2H+
N204+2HNO3-2e-=2N205+2H+
.分析:(1)金属锌与某浓度的硝酸反应时,无气体产生,应生成硝酸锌和硝酸铵;
(2)根据无污染的特点可知反应为2NH3+3O2=N2+6H2O,通入氨气的一极为负极,阴离子向负极移动;负极发生氧化反应,氨气被氧化生成氮气;
(3)电解池中生成N205 的电极发生氧化反应,N204被氧化.
(2)根据无污染的特点可知反应为2NH3+3O2=N2+6H2O,通入氨气的一极为负极,阴离子向负极移动;负极发生氧化反应,氨气被氧化生成氮气;
(3)电解池中生成N205 的电极发生氧化反应,N204被氧化.
解答:解:(1)由表中数据可知,硝酸浓度或温度不同,硝酸的含有产物不同,金属锌与某浓度的硝酸反应时,无气体产生,应生成硝酸锌和硝酸铵,反应的方程式为4Zn+10HNO3=4Zn(NO3)2+NH4NO3+H2O,可知反应中被还原的硝酸与 参加反应的硝酸物质的量之比是1:10,
故答案为:硝酸浓度或温度不同,硝酸的含有产物不同;1:10;
(2)①根据无污染的特点可知反应为2NH3+3O2=N2+6H2O,故答案为:2NH3+3O2=N2+6H2O;
②通入氨气的一极为负极,阴离子向负极移动,即由电极b向电极a移动,故答案为:由电极b向电极a移动;
③在接触面上发生的反应为负极反应,氨气被氧化生成氮气,电极方程式为2NH3+3O 2--6e-=N2+3H2O,
故答案为:2NH3+3O2--6e-=N2+3H2O;
(3)电解池中生成N205 的电极发生氧化反应,N204被氧化,电极方程式为N204+2HNO3-2e-=2N205+2H+,
故答案为:N204+2HNO3-2e-=2N205+2H+.
故答案为:硝酸浓度或温度不同,硝酸的含有产物不同;1:10;
(2)①根据无污染的特点可知反应为2NH3+3O2=N2+6H2O,故答案为:2NH3+3O2=N2+6H2O;
②通入氨气的一极为负极,阴离子向负极移动,即由电极b向电极a移动,故答案为:由电极b向电极a移动;
③在接触面上发生的反应为负极反应,氨气被氧化生成氮气,电极方程式为2NH3+3O 2--6e-=N2+3H2O,
故答案为:2NH3+3O2--6e-=N2+3H2O;
(3)电解池中生成N205 的电极发生氧化反应,N204被氧化,电极方程式为N204+2HNO3-2e-=2N205+2H+,
故答案为:N204+2HNO3-2e-=2N205+2H+.
点评:本题考查较为综合,涉及氧化还原反应的计算,硝酸的性质以及电化学知识,综合考查学生的分析能力和计算能力,为高考高频考点和常见题型,难度中等,注意电极方程式的书写.

练习册系列答案
相关题目
 H2SiO3+2OH-(或SiO32-+H2O
H2SiO3+2OH-(或SiO32-+H2O HSiO3-+OH-,HSiO3-+H2O
HSiO3-+OH-,HSiO3-+H2O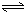 H2SiO3+OH-,AlO2-+H2O
H2SiO3+OH-,AlO2-+H2O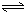 Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全
Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全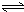 Cr2O72-+H2O
Cr2O72-+H2O