摘要:中学化学中几种常见物质的转化关系如下: 已知:构成A单质的元素的原子序数是26.将D的溶液滴入沸水中可以得到以F为分散系的红褐色胶体.请回答下题: (1)红褐色胶体中F粒子的直径大小范围为 , (2)A元素在周期表中位于第 周期第 族, (3)A.B.D的化学式分别为:A B D .H2O2的电子式为 , (4)写出鉴定E中阳离子的实验方法和现象: , (5)在C溶液中加入双氧水变成D的离子方程式: .
网址:http://m.1010jiajiao.com/timu3_id_1234050[举报]
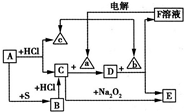 中学化学中几种常见物质的转化关系如下所示(部分反应的生成物已略去),其中A、a、c是单质,a为黄绿色气体,E为红褐色沉淀.请回答下列问题:
中学化学中几种常见物质的转化关系如下所示(部分反应的生成物已略去),其中A、a、c是单质,a为黄绿色气体,E为红褐色沉淀.请回答下列问题:(1)写出下列物质的化学式:B
FeS
FeS
,bNaOH
NaOH
.(2)D的水溶液呈 (填“酸”、“碱”或“中”)性,将饱和的D溶液加入沸水中并继续煮沸一段时间后得到的液体(填序号).
①是溶液
②是胶体
③具有丁达尔现象
④可全部透过滤纸
(3)写出下列反应的离子方程式:
①电解F的水溶液:
2Cl-+2H2O
2OH-+Cl2↑+H2↑
| ||
2Cl-+2H2O
2OH-+Cl2↑+H2↑
;
| ||
②C与等物质的量的Na2O2在溶液中反应:
4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+
4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+
. 中学化学中几种常见物质的转化关系如下图(部分产物未列出).A是一种金属单质,D是一种非金属固体单质.
中学化学中几种常见物质的转化关系如下图(部分产物未列出).A是一种金属单质,D是一种非金属固体单质.请回答下列问题:
(1)A、C的化学式分别为A
Fe
Fe
,CFe2(SO4)3
Fe2(SO4)3
.(2)F的浓溶液与A反应过程中,F体现的性质与下列反应中H2SO4体现的性质完全相同的是
C
C
.A.C+2H2SO4(浓)
| ||
B.Fe+H2SO4═FeSO4+H2↑
C.Cu+2H2SO4(浓)
| ||
D.FeO+H2SO4═FeSO4+H2O
(3)写出反应E+H2O2-→F的化学方程式:
SO2+H2O2═H2SO4
SO2+H2O2═H2SO4
.(4)若反应F+D-→E转移电子数为6.02×1023,则消耗D的质量为
8g
8g
.中学化学中几种常见物质的转化关系如下:

将D溶液滴入沸水中可得到以F为分散质的红褐色液体.请回答下列问题:
(1)红褐色液体分散质粒子直径大小的范围是
(2)B的化学式:
(3)将C与Na2O2按物质的量之比为l:1在水溶液中混合后,除有F外还有气体生成.则下列说法正确的是
A.该气体一定是氧气 B.Na2O2只是氧化剂
C.Na2O2既是氧化剂又是还原剂 D.反应后静置所得溶液呈黄色
(4)用化学用语回答下列问题:
①写出C的溶液(A→C稀硫酸过量)与双氧水反应的离子方程式:
②写出B与过量浓硫酸反应的离子反应方程式:
③写出F与A和H混合后反应生成C的离子方程式:
查看习题详情和答案>>

将D溶液滴入沸水中可得到以F为分散质的红褐色液体.请回答下列问题:
(1)红褐色液体分散质粒子直径大小的范围是
1nm-100nm
1nm-100nm
,将少量E溶液滴加到红褐色液体中会产生明显现象的过程叫聚沉
聚沉
,E中阳离子的空间构型是正四面体
正四面体
.(2)B的化学式:
FeS
FeS
.(3)将C与Na2O2按物质的量之比为l:1在水溶液中混合后,除有F外还有气体生成.则下列说法正确的是
AC
AC
.A.该气体一定是氧气 B.Na2O2只是氧化剂
C.Na2O2既是氧化剂又是还原剂 D.反应后静置所得溶液呈黄色
(4)用化学用语回答下列问题:
①写出C的溶液(A→C稀硫酸过量)与双氧水反应的离子方程式:
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
. ②写出B与过量浓硫酸反应的离子反应方程式:
3FeS+10H2SO4(浓)=3Fe2(SO4)3+9SO2↑+10H2O
3FeS+10H2SO4(浓)=3Fe2(SO4)3+9SO2↑+10H2O
.③写出F与A和H混合后反应生成C的离子方程式:
2Fe(OH)3+Fe+6H+=3Fe2++6H2O
2Fe(OH)3+Fe+6H+=3Fe2++6H2O
.中学化学中几种常见物质的转化关系如图所示(图中部分反应物或生成物及反应条件未列出).

已知:A、B、C、D是单质,其余是化合物.其中B、D是常见金属.又知A在C中点燃有苍白色火焰.请回答下列问题:
(1)W的电子式是
 .
.
(2)写出N的化学式
(3)写出下列反应的离子方程式:
反应①
反应③
K溶液和过量氨水反应
查看习题详情和答案>>

已知:A、B、C、D是单质,其余是化合物.其中B、D是常见金属.又知A在C中点燃有苍白色火焰.请回答下列问题:
(1)W的电子式是


(2)写出N的化学式
FeCl3
FeCl3
,并任写一种N的主要用途可用作催化剂、净水剂、印刷电路铜板腐蚀剂和外伤止血剂等
可用作催化剂、净水剂、印刷电路铜板腐蚀剂和外伤止血剂等
.(3)写出下列反应的离子方程式:
反应①
2Cl-+2H2O
2OH-+H2↑+Cl2↑
| ||
2Cl-+2H2O
2OH-+H2↑+Cl2↑
,
| ||
反应③
Al3++3AlO2-+6H2O═4Al(OH)3↓
Al3++3AlO2-+6H2O═4Al(OH)3↓
,K溶液和过量氨水反应
Al3++3NH3?H2O═Al(OH)3↓+3NH4+
Al3++3NH3?H2O═Al(OH)3↓+3NH4+
.中学化学中几种常见物质的转化关系如图所示:

已知:B、C、D为常见单质,其中C为气休,B、D为金属;F为常见的强酸;K常温下为气体,且能使品红溶液褪色;将E溶液滴入沸水可制得一种红褐色胶体.
请回答下列问题:
(1)若用B作阳极,D作阴极,A溶液为电解质溶液,通电一段时间后,A溶液的pH
(2)写出反应③的离子方程式
(3)写出检验G溶液中阳离子的方法
(4)实验中保存E溶液时要加入
查看习题详情和答案>>

已知:B、C、D为常见单质,其中C为气休,B、D为金属;F为常见的强酸;K常温下为气体,且能使品红溶液褪色;将E溶液滴入沸水可制得一种红褐色胶体.
请回答下列问题:
(1)若用B作阳极,D作阴极,A溶液为电解质溶液,通电一段时间后,A溶液的pH
不变
不变
(填“变大”、“变小”或“不变”).(2)写出反应③的离子方程式
2Fe3++Cu=2Fe2++Cu2+
2Fe3++Cu=2Fe2++Cu2+
,反应④的化学方程式Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
.
| ||
(3)写出检验G溶液中阳离子的方法
取G溶液少许于试管中,滴加KSCN溶液,没明显现象,再加入氯水溶液变成血红色,证明G溶液中含而Fe2+
取G溶液少许于试管中,滴加KSCN溶液,没明显现象,再加入氯水溶液变成血红色,证明G溶液中含而Fe2+
.(4)实验中保存E溶液时要加入
加入适量的稀盐酸
加入适量的稀盐酸
,用必要的文字和离子方程式解释原因Fe3++3H2O?Fe(OH)3+3H+,加盐酸抑制Fe3+的水解
Fe3++3H2O?Fe(OH)3+3H+,加盐酸抑制Fe3+的水解
.