题目内容
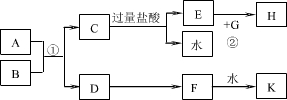
 中学化学中几种常见物质的转化关系如下图(部分产物未列出).A是一种金属单质,D是一种非金属固体单质.
中学化学中几种常见物质的转化关系如下图(部分产物未列出).A是一种金属单质,D是一种非金属固体单质.请回答下列问题:
(1)A、C的化学式分别为A
(2)F的浓溶液与A反应过程中,F体现的性质与下列反应中H2SO4体现的性质完全相同的是
A.C+2H2SO4(浓)
| ||
B.Fe+H2SO4═FeSO4+H2↑
C.Cu+2H2SO4(浓)
| ||
D.FeO+H2SO4═FeSO4+H2O
(3)写出反应E+H2O2-→F的化学方程式:
(4)若反应F+D-→E转移电子数为6.02×1023,则消耗D的质量为
| 稀硫酸 |
| 稀硫酸 |
(1)由上述分析可知,A为Fe,C为Fe2(SO4)3,
故答案为:Fe;Fe2(SO4)3;
(2)F的浓溶液与A反应过程中,硫酸体现强氧化性、酸性,A选项中浓硫酸只体现强氧化性,B选项中硫酸体现弱氧化性,C选项中浓硫酸体现强氧化性、酸性,D选项中硫酸体现酸性,
故答案为:C;
(3)E+H2O2→F的化学方程式为:SO2+H2O2═H2SO4,
故答案为:SO2+H2O2═H2SO4;
(4)F+D→E为2H2SO4(浓)+S═3SO2↑+2H2O,转移电子数为6.02×1023,其物质的量为1mol,消耗的硫的物质的量为
| 1mol |
| 4 |
其质量为0.25mol×32g/mol=8g,
故答案为:8g.

 名校课堂系列答案
名校课堂系列答案中学化学中几种常见物质的转化关系如图所示(图中部分反应物或生成物及反应条件未列出)。
 |
已知:A、B、C、D、E是单质,组成它们的元素的原子序数依次为a、b、c、d、e;且3(a + b) = 2(a + c) = 3(d -a),X、Y、Z、M、N、W、H、K是化合物,其中X是B和C的化合产物的水溶液。请回答下列问题:
(1)用电子式表示X中溶质的形成过程:_______________,组成C的元素的原子结构示意图是_____ 。
(2)写出B在氧气中燃烧生成的产物与H2O反应的化学方程式:_______________。
(3)组成单质B、C、D的三种元素简单离子的离子半径由大到小的顺序是__ _(用离子符号表示)。
(4)写出K与过量的氨水反应的化学方程式 ;写出M在水溶液中电离的方程式 。
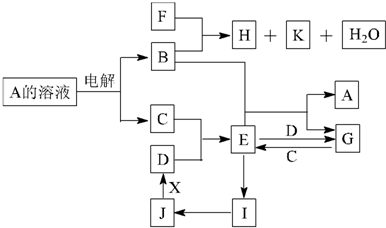
中学化学中几种常见物质的转化关系如下图所示(部分反应物、生成物及反应条件已略去):
已知:B、C、D为常见单质,其中C为气体,B、D为金属;F为常见的强酸;K常温下为气体,目能使品红溶液褪色;将 E 溶液滴入沸水可制得一种红褐色胶体; J 为红棕色固体。请回答下列问题:
 |
( l ) B 的化学式为 ;
写出 B 与 F 反应的化学方程式
( 2)实验中保存 G 溶液时要加入 目的是
( 3)为实现J一D的变化,若X是非金属单质,则X可能是 (写化学式); 若X是金属单质,请写出 J 一 D 反应的化学方程式