题目内容

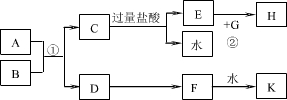
将D溶液滴入沸水中可得到以F为分散质的红褐色液体.请回答下列问题:
(1)红褐色液体分散质粒子直径大小的范围是
(2)B的化学式:
(3)将C与Na2O2按物质的量之比为l:1在水溶液中混合后,除有F外还有气体生成.则下列说法正确的是
A.该气体一定是氧气 B.Na2O2只是氧化剂
C.Na2O2既是氧化剂又是还原剂 D.反应后静置所得溶液呈黄色
(4)用化学用语回答下列问题:
①写出C的溶液(A→C稀硫酸过量)与双氧水反应的离子方程式:
②写出B与过量浓硫酸反应的离子反应方程式:
③写出F与A和H混合后反应生成C的离子方程式:
(1)红褐色液体是氢氧化铁胶体,分散质粒子直径大小的范围是1nm-100nm,将少量(NH4)2SO4溶液滴加到红褐色液体氢氧化铁胶体中会形成沉淀,过程叫聚沉;铵根离子的空间结构式正四面体结构;故答案为:1nm-100nm;聚沉;正四面体;
(2)依据推断可知B的化学式为:FeS;故答案为:FeS;
(3)将FeSO4与Na2O2按物质的量之比为l:1在水溶液中混合后,除有Fe(OH)3沉淀外还有气体O2生成,
A、气体一定是过氧化钠和水反应生成的氧气,故A正确;
B、过氧化钠既作氧化剂又做还原剂,化合价从-1价变为-2价和0价,故B错误;
C、过氧化钠既作氧化剂又做还原剂,化合价从-1价变为-2价和0价,故C正确;
D、反应后生成氢氧化铁沉淀物三价铁离子,故溶液不是黄色,故D错误;
故选AC.
故答案为:AC.
(4)①FeSO4的溶液(A→C稀硫酸过量)与双氧水在酸性溶液中反应,亚铁离子被过氧化氢氧化为三价铁,过氧化氢被还原为水,的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O;
②FeS与过量浓硫酸反应,被氧化为三价铁和二氧化硫,反应的离子反应方程式为:3FeS+10H2SO4(浓)=3Fe2(SO4)3+9SO2↑+10H2O;
③Fe(OH)3与Fe和H2SO4混合后反应生成FeSO4的离子方程式为:2Fe(OH)3+Fe+6H+=3Fe2++6H2O;
故答案为:①2Fe2++H2O2+2H+=2Fe3++2H2O;②3FeS+10H2SO4(浓)=3Fe2(SO4)3+9SO2↑+10H2O;③2Fe(OH)3+Fe+6H+=3Fe2++6H2O;

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案中学化学中几种常见物质的转化关系如图所示(图中部分反应物或生成物及反应条件未列出)。
 |
已知:A、B、C、D、E是单质,组成它们的元素的原子序数依次为a、b、c、d、e;且3(a + b) = 2(a + c) = 3(d -a),X、Y、Z、M、N、W、H、K是化合物,其中X是B和C的化合产物的水溶液。请回答下列问题:
(1)用电子式表示X中溶质的形成过程:_______________,组成C的元素的原子结构示意图是_____ 。
(2)写出B在氧气中燃烧生成的产物与H2O反应的化学方程式:_______________。
(3)组成单质B、C、D的三种元素简单离子的离子半径由大到小的顺序是__ _(用离子符号表示)。
(4)写出K与过量的氨水反应的化学方程式 ;写出M在水溶液中电离的方程式 。
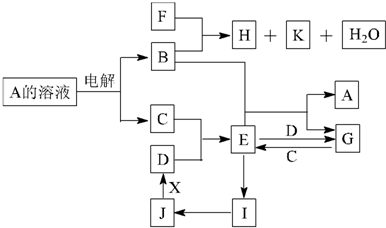
中学化学中几种常见物质的转化关系如下图所示(部分反应物、生成物及反应条件已略去):
已知:B、C、D为常见单质,其中C为气体,B、D为金属;F为常见的强酸;K常温下为气体,目能使品红溶液褪色;将 E 溶液滴入沸水可制得一种红褐色胶体; J 为红棕色固体。请回答下列问题:
 |
( l ) B 的化学式为 ;
写出 B 与 F 反应的化学方程式
( 2)实验中保存 G 溶液时要加入 目的是
( 3)为实现J一D的变化,若X是非金属单质,则X可能是 (写化学式); 若X是金属单质,请写出 J 一 D 反应的化学方程式