高一化学同步测试卤族元素
说明:本卷答题时间60分钟,满分100分。
以下数据可供解题时参考:
相对原子质量:H:1 K:39 Cl:35.5 I:127 Br:80
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题
1.医生建议甲状腺肿大的病人多食海带,这是由于海带中含有较丰富的 ( )
A.钾元素 B.铁元素 C.碘元素 D.锌元素
2.下列说法中,正确的是 ( )
A.漂白粉的有效成分是次氯酸钠 B.氯化氢在空气中呈现白烟
C.碘化钾水溶液能使淀粉变蓝 D.氟气(F2)通入水中有氧气(O2)生成
3.若用X代表F、Cl、Br、I四种卤族元素,下列属于它们共性反应的是 ( )
A.X2+H2 == 2HX B.X2+H2O == HX+HXO
C.2Fe+3X2 == 2FeX3 D.X2+2NaOH == NaX+NaXO+H2O
4.下列变化属于物理变化的是 ( )
A.氯水久置后变为无色 B.溴水中加入CCl4,振荡后溴水褪色
C.氯水漂白色素 D. AgCl见光变黑
5.加入AgNO3 溶液产生淡黄色沉淀,再加稀HNO3 沉淀不消失的是 ( )
A.NaBr溶液 B.液氯 C.Na2CO3溶液 D.氯水
6.氯化碘(ICl)的化学性质跟氯气相似,预计它跟水反应的最初生成物是 ( )
A.HI和HClO B.HCl和HIO
C.HClO3和HIO D.HClO和HIO
7.碘跟氧可以形成多种化合物,其中一种称为碘酸碘,在该化合物中,碘元素呈+3和+5两种价态,这种化合物的化学式是 ( )
A.I2O3 B.I2O
8.下列物质的保存方法正确的是 ( )
A.氢氟酸保存在塑料盖的玻璃瓶中 B.氯水保存在棕色细口瓶中
C.液溴保存在橡皮塞的玻璃瓶中 D.固态碘保存在棕色细口瓶中
9.甲、乙、丙、丁四个集气瓶中装有Cl2、H2、HCl、HBr、中的任意一种气体。若将甲和丁两瓶气体混合,见光则发生爆炸;若将甲和乙两瓶气体混合,则见瓶壁上出现深红棕色的小液滴,那么,气体乙是 ( )
A.H2 B.Cl
10.某溶液中Cl-、Br-、I-三者物质的量之比是1:2:3,通入一定量的Cl2,当反应完成后,该比值变为3:2:1,则反应的Cl2与原溶液中I-的物质的量之比是 ( )
A.1:2 B.1:
二、选择题(本题包括5小题,每小题4分,共20分。在每题给出的四个选项中,有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确给满分,但只要选错一个该小题就
11.以下各组表示卤素及其化合物的性质变化规律中,错误的是 ( )
A.得电子能力 F2>Cl2>Br2>I2 B.还原能力 F-<Cl-<Br-<I-
C.稳定性 HF>HCI>HBr>HI D.酸性 HF>HCI>HBr>HI
12.在甲、乙、丙三种溶液中各含有一种离子:CI-、Br-、I-,向甲溶液中加入淀粉溶液和氯水时,溶液变为橙色;再加入丙溶液,溶液颜色无明显变化。则乙溶液中含有的离子 ( )
A.Cl- B.Br- C.I- D.无法判断
13.鉴别Cl-、Br-、I-可以选用的试剂是 ( )
A.碘水、淀粉溶液 B.氯水、四氯化碳
C.淀粉碘化钾溶液 D.AgNO3溶液、稀HNO3
14.下列反应的离子方程式错误的是 ( )
A.碘水加到溴化钠溶液中:2 Br- + I2 === 2I- + Br2
B.氯气通入碘化钾溶液中:2I- + Cl2=== 2Cl- + I2
C.氯气溶于水:Cl2 + H2O === 2H+ + Cl-+ ClO-
D.硝酸银溶液中滴加碘化钠溶液:Ag+ + I- === AgI↓
15.含碘食盐中的碘是以碘酸钾(KIO3)形式存在的。已知在酸性溶液中IO3-和I-发生下列反应IO3-+5I-+6H+=3I2+3H2O。现有下列物质①稀硫酸;②pH试纸;③淀粉碘化钾溶液;④淀粉溶液。利用上述反应,可用来检验含碘食盐中含有IO3-的是 ( )
A.②④ B.①③ C.②③ D.①④
三、填空、简答和计算(共9个小题,满分50分)
16.(3分)将下列有关实验中所需试剂的名称填入横线上:
(1)做过碘升华的容器内壁上粘有碘,用_____________洗涤;
(2)久置石灰水后的试剂瓶用_____________洗涤;
(3)用KMnO4制取氧气后的试管用_____________洗涤。
17.(3分)盛有溴水的试管里加入过量镁粉,充分振荡、过滤,将滤液分装于A、B、C三支试管:
(1)A试管中加入AgNO3溶液,现象是
(2)B试管中加入氯水和CCl4,振荡,现象是
(3)C试管中加NaOH溶液,现象是
18.(4分)在KBr和KI的混合液中通入过量的Cl2,除了水分子外,溶液中主要有 ______分子,若把溶液蒸干得到固体主要含有 _______,固体灼烧后还剩下 ____________。
19.(4分) 已知CN-(氢氰酸根离子)和Cl-有相似之处,HCN(氢化氰)的某些性质与氯化氢相似。(CN)2(氰)与Cl2的性质有相似之处,且常温常压下也是气体。写出下列反应的化学方程式。
(1)MnO2和HCN溶液加热反应: 。
(2)(CN)2和KOH溶液反应: 。
20.(4分)铵盐受热分解的过程是铵根离子中的质子转移给酸根离子的过程。对于相同类型的铵 盐,可以根据上述反应的实质判断其热稳定性。NH
21.(9分)已知:氯化钠可以和浓硫酸反应生成硫酸钠和氯化氢.试根据下图所示的转化关系及实验现象,推断A~Y物质的化学式,
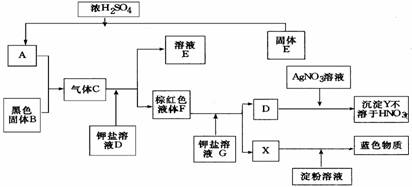
A B C D
E F G X
Y
22.(10分)海带经灼烧完全成灰,灰分中含有 等成分。某化学课外小组要从海带中提取少量的碘。
等成分。某化学课外小组要从海带中提取少量的碘。
他们的操作是:①取一定量海带,剪碎后经灼烧完全成灰;②将海带灰转移到小烧杯中,再向小烧杯中加100 mL蒸馏水,搅拌,煮沸2 - 3 min,使可溶物溶解;③过滤,向滤液中加入少量新制的饱和氯水;④向上述反应后的滤液中加入10mL某萃取剂,用力振荡后静置;⑤分液。
试据此回答有关问题
(1)③中发生反应的离子方程式为______________________________________。
(2)④操作中选用的萃取剂可以是_______
A.酒精 B.苯 C.氢氧化钠溶液 D.直馏汽油
此步操作中也可选用CCl4做萃取剂,其主要原因是____________________________
_______________________________________________________________________
若将CCl4加入到滤液中,充分静置后主要现象是______________________________
(3)第⑤操作中,要用到的主要玻璃仪器是_____________;分液时要将漏斗上口的玻璃塞打开或使上凹槽或小孔对准漏斗口上的小孔,其目的是
_____________________________________________
旋开活塞用烧杯接受液体操作时,应注意的问题是_______________________
(4)要从萃取剂中分离出碘,所用分离方法的名称是_______
23.(6分)向
24.(7分)将一定量Cl2通入250mLKBr溶液中,反应后将溶液蒸干(溴蒸气挥发掉),则知所得固体中含溴元素
(1)通入Cl2的体积(标状下)
(2)原KBr溶液的物质的量浓度。
一、选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
C
D
A
B
A
B
D
B
D
B
二、选择题
题号
11
12
13
14
15
答案
D
C
BD
C
B
三、填空、简答和计算
16.(1)酒精或氢氧化钠溶液 (2)稀盐酸或稀硝酸 (3)浓盐酸
17.(1)生成淡黄色沉淀 (2)分层,下层橙红色 (3)生成白色沉淀
18. Cl2、Br2、I2、HClO; KCl、I2; KCl
19.(1)
MnO2+ 4HCN  Mn(CN)2+(CN)2↑+2H2O(2)(CN)2+2KOH==KCN+ KCNO+ H2O
Mn(CN)2+(CN)2↑+2H2O(2)(CN)2+2KOH==KCN+ KCNO+ H2O
20.(1)NH4I>NH4Br>NH4Cl>NH
21. HCl MnO2 Cl2 KBr KCl Br2 KI I2 AgBr
22.(1)2I-+Cl ====2Cl-+I
====2Cl-+I (2)BD;四氯化碳不溶于水、碘在其中有较好的溶解度、且四氯化碳易挥发;分层,下层为紫红色,上层近于无色。(3) 使漏斗内外空气相通,以保证漏斗里液体能流出;使漏斗下端管口紧靠烧杯内壁,及时关闭活塞,不要让上层液体流出;(4)蒸馏
(2)BD;四氯化碳不溶于水、碘在其中有较好的溶解度、且四氯化碳易挥发;分层,下层为紫红色,上层近于无色。(3) 使漏斗内外空气相通,以保证漏斗里液体能流出;使漏斗下端管口紧靠烧杯内壁,及时关闭活塞,不要让上层液体流出;(4)蒸馏
23.设参加反应的Cl2的质量为x,
2NaI+Cl2==2NaCl+I
300 71 117 300-117
x
 x=
x=
答:有
24.解:Cl2+2KBr=2KCl+Br2 ∵K+:Cl-=2:1
∴KBr过量有剩余且生成的KCl物质的量等于KBr剩余的物质的量。
又∵Br元素
则:KBr剩余0.125mol,生成KCl0.125mol
(1)V(Cl)2 = (2)
(2)