网址:http://m.1010jiajiao.com/timu_id_14203[举报]
一、选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
C
D
A
B
A
B
D
B
D
B
二、选择题
题号
11
12
13
14
15
答案
D
C
BD
C
B
三、填空、简答和计算
16.(1)酒精或氢氧化钠溶液 (2)稀盐酸或稀硝酸 (3)浓盐酸
17.(1)生成淡黄色沉淀 (2)分层,下层橙红色 (3)生成白色沉淀
18. Cl2、Br2、I2、HClO; KCl、I2; KCl
19.(1)
MnO2+ 4HCN  Mn(CN)2+(CN)2↑+2H2O(2)(CN)2+2KOH==KCN+ KCNO+ H2O
Mn(CN)2+(CN)2↑+2H2O(2)(CN)2+2KOH==KCN+ KCNO+ H2O
20.(1)NH4I>NH4Br>NH4Cl>NH
21. HCl MnO2 Cl2 KBr KCl Br2 KI I2 AgBr
22.(1)2I-+Cl ====2Cl-+I
====2Cl-+I (2)BD;四氯化碳不溶于水、碘在其中有较好的溶解度、且四氯化碳易挥发;分层,下层为紫红色,上层近于无色。(3) 使漏斗内外空气相通,以保证漏斗里液体能流出;使漏斗下端管口紧靠烧杯内壁,及时关闭活塞,不要让上层液体流出;(4)蒸馏
(2)BD;四氯化碳不溶于水、碘在其中有较好的溶解度、且四氯化碳易挥发;分层,下层为紫红色,上层近于无色。(3) 使漏斗内外空气相通,以保证漏斗里液体能流出;使漏斗下端管口紧靠烧杯内壁,及时关闭活塞,不要让上层液体流出;(4)蒸馏
23.设参加反应的Cl2的质量为x,
2NaI+Cl2==2NaCl+I
300 71 117 300-117
x
 x=
x=
答:有
24.解:Cl2+2KBr=2KCl+Br2 ∵K+:Cl-=2:1
∴KBr过量有剩余且生成的KCl物质的量等于KBr剩余的物质的量。
又∵Br元素
则:KBr剩余0.125mol,生成KCl0.125mol
(1)V(Cl)2 = (2)
(2)
(1)X、Y的原子可构成一种物质,该物质与某能引起温室效应的气体结构相同;该物质的电子式是


(2)下列含氧酸根离子的化学式书写不正确的是
a.XO3- b.XO32- c.YO32- d.Y2O32- e.YO3- f.YO42-
(3)Z单质与其它化合物可满足如图所示转化关系:

①C溶液在储存时应加入少量Z,其理由是(用文字和离子方程式回答)
②将5~6滴B的饱和溶液滴入沸水中,可得到红褐色液体,该液体能产生丁达尔效应.该反应的离子方程式为
(4)Y的最高价含氧酸是重要的化工产品.
①已知YO2被空气氧化,每生成1mol气态YO3,放出98.3kJ热量.该反应的热化学方程式是
| 1 |
| 2 |
| 1 |
| 2 |
②实验测得相同条件下一定量的Y单质分别在空气和在氧气中充分燃烧后产物的成分(体积分数)如下表.
| YO2 | YO3 | |
| 空气 | 94%-95% | 5%-6% |
| 氧气 | 97%-98% | 2%-3% |
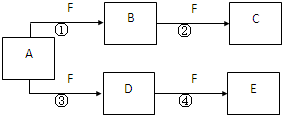 X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,D的钠盐是一种致癌物质,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.
X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,D的钠盐是一种致癌物质,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.回答下列问题:
(1)Z元素的原子结构示意图为
(2)A的电子式为
(3)写出下列反应的化学方程式:①
(4)A和E反应生成G,Z2Y是一种麻醉剂,由G在210℃分解生成,该分解反应的化学方程式为
(5)常温下,G的水溶液的PH=5,则由水电离的氢离子浓度为
X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍。A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示(部分反应条件略去)。
请回答下列问题:
(1)Z元素的原子结构示意图为 。
(2)A的电子式为 ,D的化学式为 。
(3)E通过 反应可以生成C(填序号,有一个或多个选项符合题意)。
a.分解 b.复分解 c.氧化还原 d.置换
(4)写出下列反应的化学方程式:① ,③ 。
(5)A和E化合生成G,Z2Y是一种麻醉剂,由G在210℃分解生成,该分解反应的化学方程式为 。
查看习题详情和答案>>
X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍。A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示(部分反应条件略去)。
请回答下列问题:
(1)Z元素的原子结构示意图为 。
(2)A的电子式为 ,D的化学式为 。
(3)E通过 反应可以生成C(填序号,有一个或多个选项符合题意)。
a.分解 b.复分解 c.氧化还原 d.置换
(4)写出下列反应的化学方程式:① ,③ 。
(5)A和E化合生成G,Z2Y是一种麻醉剂,由G在210℃分解生成,该分解反应的化学方程式为 。
X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍。A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示。

回答下列问题:
(1)A的电子式为 。
(2)A和E反应生成G,C与G中都含有 (填化学键的类型)。
(3)反应③中如果转移的电子为3 mol,则被氧化的A为 mol。
(4)科学家发明了使ZX3直接用于燃料电池的方法,其装置用铂作电极,加入碱性电解质溶液,往一极通入空气,另一电极通入ZX3并使之转化为无污染的气体,试写出负极的电极反应式: 。
(5)由Z、X两元素形成的含10个电子的阳离子可和XSO4-形成一种盐A,若往A的溶液中缓缓滴入稀NaOH溶液至溶液恰好呈中性,则溶液中所含离子浓度由大到小的顺序为: 。
查看习题详情和答案>>