网址:http://m.1010jiajiao.com/timu_id_14202[举报]
一、选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
C
D
A
B
A
B
D
B
D
B
二、选择题
题号
11
12
13
14
15
答案
D
C
BD
C
B
三、填空、简答和计算
16.(1)酒精或氢氧化钠溶液 (2)稀盐酸或稀硝酸 (3)浓盐酸
17.(1)生成淡黄色沉淀 (2)分层,下层橙红色 (3)生成白色沉淀
18. Cl2、Br2、I2、HClO; KCl、I2; KCl
19.(1)
MnO2+ 4HCN  Mn(CN)2+(CN)2↑+2H2O(2)(CN)2+2KOH==KCN+ KCNO+ H2O
Mn(CN)2+(CN)2↑+2H2O(2)(CN)2+2KOH==KCN+ KCNO+ H2O
20.(1)NH4I>NH4Br>NH4Cl>NH
21. HCl MnO2 Cl2 KBr KCl Br2 KI I2 AgBr
22.(1)2I-+Cl ====2Cl-+I
====2Cl-+I (2)BD;四氯化碳不溶于水、碘在其中有较好的溶解度、且四氯化碳易挥发;分层,下层为紫红色,上层近于无色。(3) 使漏斗内外空气相通,以保证漏斗里液体能流出;使漏斗下端管口紧靠烧杯内壁,及时关闭活塞,不要让上层液体流出;(4)蒸馏
(2)BD;四氯化碳不溶于水、碘在其中有较好的溶解度、且四氯化碳易挥发;分层,下层为紫红色,上层近于无色。(3) 使漏斗内外空气相通,以保证漏斗里液体能流出;使漏斗下端管口紧靠烧杯内壁,及时关闭活塞,不要让上层液体流出;(4)蒸馏
23.设参加反应的Cl2的质量为x,
2NaI+Cl2==2NaCl+I
300 71 117 300-117
x
 x=
x=
答:有
24.解:Cl2+2KBr=2KCl+Br2 ∵K+:Cl-=2:1
∴KBr过量有剩余且生成的KCl物质的量等于KBr剩余的物质的量。
又∵Br元素
则:KBr剩余0.125mol,生成KCl0.125mol
(1)V(Cl)2 = (2)
(2)
| 物 质 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) |
| 乙 醇 | -117.0 | 78.0 | 0.79 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | - | 338.0 | 1.84 |
①在30mL的大试管A中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合溶液.
②按如图1所示连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10分钟
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置,等待分层.
④分离出乙酸乙酯层并洗涤、干燥.
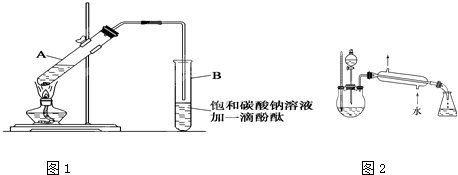
请根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为:______,写出制取乙酸乙酯的化学方程式:______.
(2)上述实验中饱和碳酸钠溶液的作用是:______(填字母).
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于其分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要理由是:______.
(4)指出步骤③所观察到的现象:______;分离出乙酸乙酯层后,一般用饱和食盐水和饱和氯化钙溶液洗涤,可通过洗涤除去______(填名称)杂质;为了干燥乙酸乙酯,可选用的干燥剂为______(填字母).
A.P2O5 B.无水Na2SO4 C.碱石灰 D.NaOH固体
(5)某化学课外小组设计了如图2所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),试分析与上图的装置相比,此装置的主要优点.
| 物 质 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) |
| 乙 醇 | -117.0 | 78.0 | 0.79 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | - | 338.0 | 1.84 |
①在30mL的大试管A中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合溶液.
②按如图1所示连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10分钟
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置,等待分层.
④分离出乙酸乙酯层并洗涤、干燥.
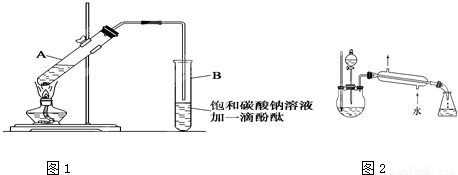
请根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为:______,写出制取乙酸乙酯的化学方程式:______.
(2)上述实验中饱和碳酸钠溶液的作用是:______(填字母).
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于其分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要理由是:______.
(4)指出步骤③所观察到的现象:______;分离出乙酸乙酯层后,一般用饱和食盐水和饱和氯化钙溶液洗涤,可通过洗涤除去______(填名称)杂质;为了干燥乙酸乙酯,可选用的干燥剂为______(填字母).
A.P2O5 B.无水Na2SO4 C.碱石灰 D.NaOH固体
(5)某化学课外小组设计了如图2所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),试分析与上图的装置相比,此装置的主要优点.
查看习题详情和答案>>
(13分)一定条件下铁可以和CO2发生反应: Fe(s)+CO2(g)FeO(s)+CO(g);△H>0
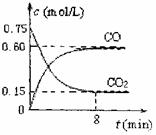
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,求8分钟内CO的平均反应速率v(CO)= 。
(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
A.升高温度 B.增大压强 C.充入一定量氮气 D.再加入一些铁粉
(3)反应达到平衡后,若保持容器体积不变时,再通入一定量的CO2,则CO2的转化率将 (填“增大”、“减小”、“不变”)
(4)铁的重要化合物在生产生活中应用十分广泛。
①FeCl3溶液可用于天然气脱硫,写FeCl3溶液与天然气中H2S反应的离子方程式:
。
②高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为 。
(5)已知:2CO(g)+O2(g)==2CO2(g) △H=-566 kJ/mol;2H2(g)+O2(g)==2H2O(g) △H=-483.6 kJ/mol。写出CO和H2O(g)作用生成CO2和H2的热化学方程式
。
查看习题详情和答案>>
(13分)一定条件下铁可以和CO2发生反应: Fe(s)+CO2(g) FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,求8分钟内CO的平均反应速率v(CO)= 。

(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
A.升高温度 B.增大压强 C.充入一定量氮气 D.再加入一些铁粉
(3)反应达到平衡后,若保持容器体积不变时,再通入一定量的CO2,则CO2的转化率将 (填“增大”、“减小”、“不变”)
(4)铁的重要化合物在生产生活中应用十分广泛。
①FeCl3溶液可用于天然气脱硫,写FeCl3溶液与天然气中H2S反应的离子方程式:
。
②高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为 。
(5)已知:2CO(g)+O2(g)==2CO2(g) △H=-566 kJ/mol;2H2(g)+O2(g)==2H2O(g) △H=-483.6 kJ/mol。写出CO和H2O(g)作用生成CO2和H2的热化学方程式
。
查看习题详情和答案>>
一定条件下铁可以和CO2发生反应:
 Fe(s)+CO2(g)
Fe(s)+CO2(g)![]() FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0
(1)一定温度下,向某密闭容器中加入足量铁粉并
充入一定量的CO2气体,反应过程中CO2气体和
CO气体的浓度与时间的关系如图所示,求8分钟
内CO的平均反应速率v(CO)= 。
(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
A.升高温度 B.增大压强 C.充入一定量氮气 D.再加入一些铁粉
(3)反应达到平衡后,若保持容器体积不变时,再通入一定量的CO2,则CO2的转化率将
(填“增大”、“减小”、“不变”)
(4)铁的重要化合物在生产生活中应用十分广泛。
①FeCl3溶液可用于天然气脱硫,写FeCl3溶液与天然气中H2S反应的离子方程式:
。
②高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为 。
(5)已知:2CO(g)+O2(g)==2CO2(g) △H=-566 kJ/mol;2H2(g)+O2(g)==2H2O(g) △H=-483.6 kJ/mol。写出CO和H2O(g)作用生成CO2和H2的热化学方程式
。
查看习题详情和答案>>