2008年11月
绵阳南山中学2008年秋季高2010 级半期考试
化学试题
命题:张明盛 审核:卿明华
可能用到的相对原子质量: H 1 O 16 Al 27
第I 卷(选择题,共50 分)
一、选择题(本题包括20个小题,每小题只有一个正确答案,每题2.5分,共50分)
1.下列过程或现象与盐类水解无关的是
A.纯碱溶液去油污 B.铁在潮湿的环境下生锈
C.加热氯化铁溶液颜色变深 D.浓硫化钠溶液有臭鸡蛋味
2.要使氯化铝溶液中的Al3+完全转化成Al(OH)3沉淀,应选用的适宜试剂是
A.NaOH溶液 B.稀HCl C.氨水 D.AgNO3溶液
3. H++OH-;反应吸热,下列叙述正确的是
H++OH-;反应吸热,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,KW增大,pH不变
4.
2SO2+
O2 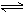 2SO3达到平衡后改变下述条件,SO3气体平衡浓度不改变的是
2SO3达到平衡后改变下述条件,SO3气体平衡浓度不改变的是
A.温度和压强不变,充入1mol SO3 B.温度和体积不变,充入1mol SO3
C.温度和压强不变,充入1molAr D.温度和压强不变,充入1mol O2
5.反应CO+NO2 CO2+NO在一定条件下达平衡,降温,物质颜色变浅。下列说法正确的是
CO2+NO在一定条件下达平衡,降温,物质颜色变浅。下列说法正确的是
A.正反应是吸热反应 B.降温后CO浓度增大
C.再加O2,平衡左移 D.再加O2,平衡右移
6.制印刷电路时常用氯化铁作腐蚀液,有关反应为2FeCl3 + Cu =2FeCl2 + CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,烧杯中不可能出现的是
A.有铜无铁 B.有铁无铜 C.铁、铜都有 D.铁、铜都无
7.pH为2的盐酸A与pH为11的NaOH溶液B,在常温下,当它们按一定体积比混合时,溶液的pH恰好为7,则A与B的体积比为
A.1:1
B.2:
8.下列能说明反应H2(g) + I2(g) 2HI(g)达到平衡状态的是
2HI(g)达到平衡状态的是
A.υ(H2)=υ(I2) B.气体的压强和密度保持不变
C.生成氢气的速率等于生成HI速率的一半 D.混合气的浓度相同
9.在一个VL的密闭容器中放入
 nC(g) + 2D(g),达到平衡后,A的浓度减少,混合气体的平均式量增大,则反应式中n值为:
nC(g) + 2D(g),达到平衡后,A的浓度减少,混合气体的平均式量增大,则反应式中n值为:
A.1
B.
10.给N2O4(g) 2NO2(g)
(正反应吸热)降温,产生的影响是
2NO2(g)
(正反应吸热)降温,产生的影响是
A.υ正和υ逆不同程度减小 B.υ正和υ逆不同程度增大
C.υ正增大υ逆减小 D.υ正减小υ逆增大
11.
A.c(NH4+)=c(SO42-) B.c (NH4+)<c(SO42-)
C.c(NH4+)>c(SO42-) D.c (OH-)+ c(SO42-)=c (H+)+ c (NH4+)
12.能正确表示下列反应的离子方程式是
A.醋酸钠的水解反应CH3OO-+H3O+=CH3COOH+H2O
B.碳酸氢钙与过量的NaOH溶液反应Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
C.金属铝溶于氢氧化钠溶液 Al + 2OH-=AlO2-+ H2 ↑
D.稀硝酸与过量的铁屑反应 3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O
|
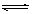 pC(g)在不同温度(T)、压强(P)下,生成物C的物质的量分数x(C)的变化情况。下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是
pC(g)在不同温度(T)、压强(P)下,生成物C的物质的量分数x(C)的变化情况。下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是
 A.吸热反应,m+n<P
A.吸热反应,m+n<P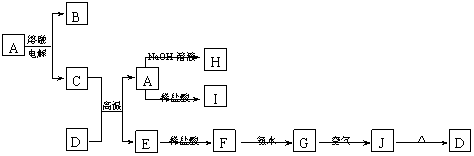
 (4)A与NaOH反应的离子方程式为 ,所得溶液显碱性的原因(用离子方程式表示) 。
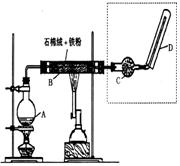
(4)A与NaOH反应的离子方程式为 ,所得溶液显碱性的原因(用离子方程式表示) 。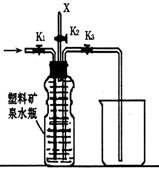 (3)某次实验后,取B中的固体少量,溶于足量稀盐酸,再滴加KSCN溶液。溶液颜色无明显变化,试解释原因(用离子方程式表示)
。
(3)某次实验后,取B中的固体少量,溶于足量稀盐酸,再滴加KSCN溶液。溶液颜色无明显变化,试解释原因(用离子方程式表示)
。 Al2O3+2Fe
Al2O3+2Fe  (4)2Al
+2OH-+2 H2Oㄔ2
Al O2-+3H2↑;Al
O2-+2H2O Al (OH)3+ OH-(各2分)
(4)2Al
+2OH-+2 H2Oㄔ2
Al O2-+3H2↑;Al
O2-+2H2O Al (OH)3+ OH-(各2分)