摘要:24.(1)Al2O3,偏铝酸钠 2+2H2O+O2ㄔ4Fe(OH)3
网址:http://m.1010jiajiao.com/timu_id_182233[举报]
(1)真空碳热还原-氯化法可实现由铝土矿制备金属铝,相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H=a kJ?mol-1
3AlCl(g)═2Al(l)+AlCl3(g)△H=b kJ?mol-1
①反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=
②Al4C3是反应过程中的中间产物.Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39kJ?mol-1
2H2O2(aq)═2H2O(l)+O2(g)△H=-196.46kJ?mol-1
H2(g)+
O2(g)═H2O(l)△H=-285.84kJ?mol-1
则H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为
查看习题详情和答案>>
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H=a kJ?mol-1
3AlCl(g)═2Al(l)+AlCl3(g)△H=b kJ?mol-1
①反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=
a+b
a+b
kJ?mol-1(用含a、b的代数式表示).②Al4C3是反应过程中的中间产物.Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为
Al4C3+12HCl═4AlCl3+3CH4↑
Al4C3+12HCl═4AlCl3+3CH4↑
.(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39kJ?mol-1
2H2O2(aq)═2H2O(l)+O2(g)△H=-196.46kJ?mol-1
H2(g)+
| 1 | 2 |
则H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为
Cu(s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O(l)△H=-319.6 kJ/mol
Cu(s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O(l)△H=-319.6 kJ/mol
.碳、氮和铝的单质及其化合物在工农业生产和生活中有重要作用.
(1)真空碳热还原一氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
2Al2O3(s)+2AlCl3(g)+6C(s)=6AlCl(g)+6CO(g);△H=a kJ?mol-1
3AlCl(g)=2Al(l)+AlCl3(g);△H=b kJ?mol-1
反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H= kJ?mol-1
(用含a、b的代数式表示).
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g);△H=Q kJ?mol-1.在T1℃时,反应进行到不同时间测得各物质的浓度如下:
①0~10min内,NO的平均反应速率v(NO)= ,T1℃时,该反应的平衡常数K=
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)
a.通入一定量的NO b.加入一定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q 0(填“>”或“<”).
④在恒容绝热条件下,能判断该反应一定达到化学平衡状态的依据是 (填选项编号)
a.单位时间内生成2nmol NO(g)的同时消耗nmol CO2(g)
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变.
查看习题详情和答案>>
(1)真空碳热还原一氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
2Al2O3(s)+2AlCl3(g)+6C(s)=6AlCl(g)+6CO(g);△H=a kJ?mol-1
3AlCl(g)=2Al(l)+AlCl3(g);△H=b kJ?mol-1
反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=
(用含a、b的代数式表示).
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g);△H=Q kJ?mol-1.在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(min) 浓度(mol/L) |
0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是
a.通入一定量的NO b.加入一定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q
④在恒容绝热条件下,能判断该反应一定达到化学平衡状态的依据是
a.单位时间内生成2nmol NO(g)的同时消耗nmol CO2(g)
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变.
 二甲醚(CH3OCH3)是无色气体,可作为一种新型能源.由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源.由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:甲醇合成反应:
(Ⅰ)CO(g)+2H2(g)═CH3OH(g)△H1=-90.1kJ?mol-1
(Ⅱ)CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2=-49.0kJ?mol-1
水煤气变换反应:
(Ⅲ)CO(g)+H2O(g)═CO2(g)+H2 (g)△H3=-41.1kJ?mol-1
二甲醚合成反应:
(Ⅳ)2CH3OH(g)═CH3OCH3(g)+H2O(g)△H4=-24.5kJ?mol-1
回答下列问题:
(1)Al2O3是合成气直接制备二甲醚反应催化剂的主要成分之一.工业上从铝土矿制备较高纯度Al2O3的主要工艺流程是
Al2O3(铝土矿)+2NaOH+3H2O=2NaAl(OH)4,NaAl(OH)4+CO2=Al(OH)3↓+NaHCO3,2Al(OH)3
Al2O3+3H2O
| ||
Al2O3(铝土矿)+2NaOH+3H2O=2NaAl(OH)4,NaAl(OH)4+CO2=Al(OH)3↓+NaHCO3,2Al(OH)3
Al2O3+3H2O
(以化学方程式表示).
| ||
(2)分析二甲醚合成反应(Ⅳ)对于CO转化率的影响
消耗甲醇,促进甲醇合成反应(Ⅰ)平衡右移,CO转化率增大;生成的H2O,通过水煤气变换反应(Ⅲ)消耗部分CO
消耗甲醇,促进甲醇合成反应(Ⅰ)平衡右移,CO转化率增大;生成的H2O,通过水煤气变换反应(Ⅲ)消耗部分CO
.(3)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为
2CO(g)+4H2(g)=CH3OCH3+H2O(g)△H=-204.7kJ?mol-1
2CO(g)+4H2(g)=CH3OCH3+H2O(g)△H=-204.7kJ?mol-1
.根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响该反应分子数减少,压强升高使平衡右移,CO和H2转化率增大,CH3OCH3产率增加.压强升高使CO和H2浓度增加,反应速率增大
该反应分子数减少,压强升高使平衡右移,CO和H2转化率增大,CH3OCH3产率增加.压强升高使CO和H2浓度增加,反应速率增大
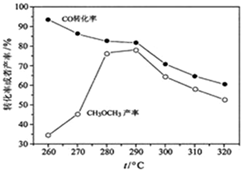
.(4)有研究者在催化剂(含Cu-Zn-Al-O和Al2O3)、压强为5.0MPa的条件下,由H2和CO直接制备二甲醚,结果如图所示.其中CO转化率随温度升高而降低的原因是
反应放热,温度升高,平衡左移
反应放热,温度升高,平衡左移
.(5)二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度等于甲醇直接燃料电池(5.93kW?h?kg-1).若电解质为酸性,二甲醚直接燃料电池的负极反应为
CH3OCH3+3H2O=2CO2+12H++12e-
CH3OCH3+3H2O=2CO2+12H++12e-
,一个二甲醚分子经过电化学氧化,可以产生12
12
个电子的能量;该电池的理论输出电压为1.20V,能量密度E=1.2V×
| ||
|
1.2V×
| ||
|
保护自然环境已成为人类社会可持续发展的重要课题.
(1)正常雨水偏酸性,pH约为 (填“5.6”、“7.0”或“8.4”),这是因为大气中的CO2溶于雨水生成了碳酸,该反应的化学方程式为 .某工厂每小时燃烧含硫1%的煤5t,若硫全部转化为SO2,则该厂每天产生SO2 t.下列反应可减少SO2的排放量:2CaCO3+O2+2SO2═2X+2CO2,其中X的化学式为 .
(2)用硫酸处理含烧碱废水的有关反应的离子方程式为 .
(3)下列做法不利于节能减排、保护环境的是 (填字母代号).
A.推广使用无磷洗涤剂 B.开发利用太阳能、风能、地热能等
C.推广垃圾分类、回收利用 D.大量使用一次性筷子和塑料袋等. 查看习题详情和答案>>
(1)正常雨水偏酸性,pH约为
(2)用硫酸处理含烧碱废水的有关反应的离子方程式为
(3)下列做法不利于节能减排、保护环境的是
A.推广使用无磷洗涤剂 B.开发利用太阳能、风能、地热能等
C.推广垃圾分类、回收利用 D.大量使用一次性筷子和塑料袋等. 查看习题详情和答案>>