2008-2009学年无棣二中第五次月考试题
化学试卷
2009.42
1.本卷总分100分。
2.可能使用的相对原子质量:H
Mg-24 Al-27 Fe-56
第Ⅰ卷(选择题,共48分)
一、单项选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意)
1.化学与生活是紧密相联的,下列关于生活化学的说法正确的是
A.随着人们生活节奏的加快,方便的小包装食品已被广泛接受,为了防止中秋月饼等富脂食品氧化变质,延长食品的保质期,在包装袋中常放入生石灰
B.现在用的清洁燃料主要有两类:一类是压缩天然气,另一类为液化石油气,它们属于碳氢化合物
C.福尔马林是一种良好的杀毒剂,也可用来消毒自来水
D.保护加酶洗衣粉的洗涤效果,应用沸水溶解洗衣粉
2.目前人类已发现的非金属元素除稀有气体外,共有16种。下列对这16种非金属元素的相关判断:①都是主族元素,最外层电子数都大于4;②单质在反应中都只能作氧化剂;③氢化物常温下都是气态,所以又都叫气态氢化物;④氧化物常温下都可以与水反应生成酸( )
A.只有②③正确 B.只有①③正确
C.只有④正确 D.①②③④均不正确
3.在5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O中,被氧化的氯元素与被还原的氯元素的质量比为
(
) A.1:1 B.5:
4.为了保护地下钢管不受腐蚀可采用的方法是 ( )
A将它与直流电源负极相连 B将它与直流电源正极相连
C将它与铜板相连 D将它与锡板相连
5.强酸与强碱的稀溶液发生中和反应的热效应:
H+(aq)+OH―(aq)=H2O(l) △H=-57.3kJ/mol,
向
A.△H1>△H2>△H3 B.△H1<△H3<△H2
C.△H2>△H1>△H3 D.△H1>△H3>△H2
6.NA表示阿伏加德罗常数。下列说法中正确的是( )
A.
B.203gMgCl2?6H2O晶体中含有的Mg2+离子不足NA个
C.200mL1mol/LAl2(SO4)3溶液中,Al3+和SO42-离子数的总和是NA
D.Na2O2与H2O反应生成
7.常温下将稀NaOH溶液与稀CH3COOH溶液混合,不可能出现的结果是( )
A.pH > 7,且c(OH―) > c(Na+) > c(H+) > c(CH3COO―)
B.pH > 7,且c(Na+) + c(H+) = c(OH―) + c(CH3COO―)
C.pH < 7,且c(CH3COO―) >c(H+) > c(Na+) > c(OH―)
D.pH = 7,且c(CH3COO―) = c(Na+) > c(H+) = c(OH―)
8. 某可逆反应L(s)+G(g) 3R(g);△H= ―QkJ/mol,
3R(g);△H= ―QkJ/mol,
 本图表示外界条件温度、压强的变化对上述反应的影
本图表示外界条件温度、压强的变化对上述反应的影
响。试判断图中y轴可以表示 ( )
A.平衡混合气中R的质量分数
B.达到平衡时G的转化率
C.平衡混合气中G的质量分数
D.达到平衡时L的转化率
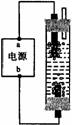 9。某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是( )
9。某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是( )
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极,b为阳极;HClO和NaCl
10.一定温度下,在恒容密闭容器中发生如下反应:

A.2 mol C B.2 mol A、2 mol B和1 mol He(不参加反应)
C.1 mol B和1 mol C D.2 mol A、3 mol B和3 mol C
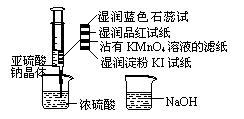 11.如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )
11.如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )
A.蓝色石蕊试纸先变红后褪色
B.品红试纸、沾有KMnO4溶液滤纸均褪色
证明了SO2漂白性
C.湿润淀粉KI试纸未变蓝说明SO2的氧化
性弱于I2
D.实验室用氨水溶液除去多余的SO2
12.下列各组离子,在指定的环境中一定能大量共存的是( )
A.滴加石蕊试液显红色的溶液:Fe3+、NH4+、C1-、SCN-
B.含有大量HCO3-的溶液:NH4+、Ca2+、Mg2+、I-
C.在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3-
D.含有大量ClO-的溶液:H+、Mg2+、I-、SO42-
13.两种气态混合烃,在
A.CH4、C2H4 B.CH4、C3H
14.能正确表示下列反应离子方程式的是( )
A.过氧化钠固体与水反应:2O22―+2H2O == 4OH-+O2↑
B.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
C.次氯酸钙溶液中通入少量SO2:Ca2++2 ClO-+H2O+SO2 == CaSO3↓+2HClO
D.向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:
 2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
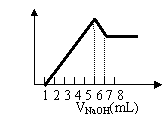
15.把镁铝合金用稀硫酸溶解,加入氢氧化钠溶液的体积
与生成沉淀的质量关系如右图,则合金中镁和铝的质
量比是 ( )
A.2∶3 B.8∶
16.把一定量的Na2O2和NaHCO3混合粉末分为两等份,将其中一份加入到100mL稀盐酸中恰好完全反应,生成干燥的气体
A
B
C
D
Na2O2和NaHCO3的
物质的量之比
8?1
9?2
1?8
2?9
原稀盐酸的
物质的量浓度(mol/L)
3.2
1.1
1.8
1.3
2008-2009学年无棣二中第五次月考试题
化学试卷
1.本卷总分100分。
2.可能使用的相对原子质量:H
Na-23 Mg-24 Al-27 Fe-56
第Ⅱ卷(非选择题,共52分)
二、(本题包括4小题,共40分)
17.(3分)下列有关实验的叙述中,不正确的有 。
①蒸干AlCl3溶液可得纯净的无水氯化铝;②试管里加入少量淀粉,再加入一定量稀硫酸,加热3~4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现;③无法用分液漏斗将甘油和水的混合液体分离;④用酸式滴定管量取20.00mL高锰酸钾酸性溶液;⑤为了测定某溶液的pH,将未经湿润的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比;⑥苯与溴水在铁粉的催化作用下制备溴苯;⑦配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止。
18.(13分)某研究性学习小组为探究铜、锌与浓盐酸反应,设计实验探究方案如下:
(一)实验用品:纯锌片、铜片、37%的浓盐酸、蒸馏水、氯化铜溶液
(二)实验记录:
交流卡片
主题:Zn、Cu与浓盐酸间的实验
A.将锌放入浓盐酸的实验
B.将锌与铜片贴在一起,一同放入浓盐酸中,反应快速放出气体
C.当实验B中锌片完全溶解后,将溶液加热,又产生大量气体,得到无色溶液
D.将实验C反应后的溶液隔绝空气,加入适量水,出现白色沉淀
(三)背景资料
资料卡片
主题:生成一价铜的反应
 ① 必修一,P116:4CuO
=== 2Cu2O + O2↑
① 必修一,P116:4CuO
=== 2Cu2O + O2↑
②《无机化学》下册,p705:2Cu2+ + 4I- == 2CuI(白色)↓+ I2
③《无机化学》下册,p706:氯化亚铜(CuCl)在不同浓度的KCl溶液中可形成[CuCl4]3+等无色离子。
(四)请你参与以下探究
(1)实验A反应速度明显比B小,原因是 。
(2)根据“铜位于金属活动顺序表氢之后,与稀盐酸不反应,而在实验C中加热时又产生气体”的事实,作出如下推断:
①有同学认为“实验C中加热时产生的气体是溶解在溶液中的H
②某同学作了如下猜想:是否成立?请你设计实验方案加以验证。
猜想
验证方法
预测现象及结论
认为铜片中可能含有锌等杂质
(3)某同学对实验D中的白色沉淀进行分析:“不可能是CuCl2,因为CuCl2能溶于水且溶液显蓝色;也不可能是ZnCl2,因为稀释后溶液更稀,不会析出ZnCl2晶体。若利用资料卡片资料①②大胆猜想,白色沉淀可能是CuCl。请你帮他设计验证方案。
猜想
预设验证方法
猜想的现象与结论
白色沉淀
是氯化亚铜
(4)指导老师肯定了实验D中的白色沉淀是CuCl;并指出生成沉淀的原因,实际上是[CuCl4]3-等离子与CuCl(s)、Cl-三者之间所形成的沉淀溶解平衡移动的结果。请写出这一平衡关系式(用离子方程式表示)
。
19.(12分)氧族元素的各种性质可归纳整理出如下(部分):
元素
性质
8O
16S
Se
52Te
单质沸点(℃)
-183
444.6
685
1390
主要化合价
-2
-2,+4,+6
-2,+4,+6
原子半径(nm)
0.074
0.102
0.116
0.143
单质与H2反应
点热易化合
加热化合
加热难化合
不能直接化合
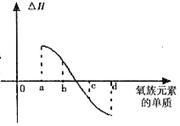 回答下列问题:
回答下列问题:
|

 21。(12分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2 (g) + 3 H2(g) 2NH3(g)
21。(12分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2 (g) + 3 H2(g) 2NH3(g) (4)[CuCl4]3-(aq) CuCl(s) +
3Cl-(aq) (2分)
(4)[CuCl4]3-(aq) CuCl(s) +
3Cl-(aq) (2分) (2分)
(2分) 解法二: N2 + 3H2 2NH3
解法二: N2 + 3H2 2NH3