网址:http://m.1010jiajiao.com/timu_id_155076[举报]
一、单项选择题(本题包括16小题,每小题3分,共48分)
1、B 2、D 3、B 4、A 5、D 6、A 7、A 8、C
9、B 10、A 11、C 12、B 13、B 14、B 15、B 16、D
二、(本题包括2小题,共40分)
17。(3分)①②⑤⑥
18.(13分)(1)铜锌及浓盐酸一起组成了原电池,加快了反应速率(2分)
(2)①没道理,因为H2本身难溶于水(2分)
②(2分)
将铜片加入稀硫酸中,并微热
若无气体放出,则不含锌等活泼金属杂质;若有气体则有锌等杂质
(3)(5分)
白色沉淀是氯化亚铜
向白色沉淀中加入稀HNO3等强氧化剂
溶液变蓝色,说明是一价铜
向氯化亚铜悬浊液中加入氯化钾溶液
如白色沉淀消失且得无色溶液,则原溶液为氯化亚铜,否则不是
 (4)[CuCl4]3-(aq) CuCl(s) +
3Cl-(aq) (2分)
(4)[CuCl4]3-(aq) CuCl(s) +
3Cl-(aq) (2分)
19.(12分)
(1) (2分)
(2分)
(2)Cl2+H2O2==2HCl+O2(2分)
(3)-2、+4、+6(2分)
(4)Al2Te3+6H2O==2Al(OH)3↓+3H2Te↑(或其它合理答案(2分)
(5)Se(2分)O2(2分)
20.(12分)(1)使Al3+、Fe3+完全沉淀(2分)
(2)Ca2++(NH4) CaC2O4↓+2NH4+(2分)
(3)Fe(OH)3、Al(OH)3(各1分,共2分)
(4)Fe3++3SCN― Fe(SCN)3(写成其它正确的络合离子形式给分,2分)
(5)使Fe3+转化为Fe(OH)3沉淀;检验Al3+(或铝元素)存在。(各2分,共4分)
三、(本题包括1小题,共12分)
21。⑴解法一:由反应的化学方程式得知,反应掉的N2和生成NH3的物质的量之比为1∶2,设反应掉的N2的物质的量为x mol。则 x∶6 = 1∶2 解之x =
 解法二: N2 + 3H2 2NH3
解法二: N2 + 3H2 2NH3
开始时 a b 0
t时13
6
在t时生成 6 mol NH3,消耗了3 mol N2,所以a = 13 + 3 = 16
⑵n平(NH3) =
⑶5∶4 ⑷2∶3 ⑸1∶2 ⑹ 3∶3∶2
(各2分,共12分)
A.蒸干AlCl3溶液可得纯净的无水氯化铝;
B.可用酒精清洗附着有碘晶体的试管;
C.检查容量瓶是否漏水的方法是:往容量瓶中加水,塞好瓶塞,将容量瓶倒过来,若不漏水,将瓶塞旋转180°,再倒过来,看是否漏水;
D.向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体;
E.为了测定某溶液的pH,将未经湿润的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比;
F.钠、钾着火时,应立即用沙子扑灭;
G.用苯与溴水在铁粉的催化作用下制备溴苯;
H.配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加稀氨水,直至沉淀刚好溶解为止。
查看习题详情和答案>>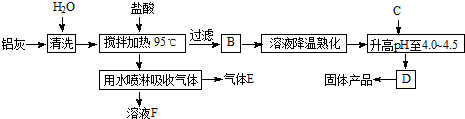
(1)反应中副产品E是
(2)升高pH至4.0~4.5的目的是
(3)生产过程中可循环使用的物质是
(4)为使得到的晶体较纯净,生产过程中使pH升高的c物质可选用
a.NaOH b.Al c.氨水 d.A12O3 e.NaAlO2
(5)为测定[A12(OH)nCl6-n.?H2O]m中的n值,进行如下实验:
①称取ag晶体,制成粉末,加热至质量不再变化时,得到bg固体.此过程可能用到的 下列仪器有
a.蒸发皿 b.坩埚 c.研钵 d.试管
②另取a g晶体,进行如下操作:
用A试剂溶解→加足量AgNO3溶液→操作c→烘干→称量为c g固体.试剂A为
下列实验操作都能达到预期目的是
①蒸干AlCl3溶液可得纯净的无水氯化铝;②可以采用多次盐析或多次渗析的方法分离、提纯蛋白质;③用广泛pH试纸测得某溶液pH为3.5;④滴入酚酞溶液确定纯碱中有无烧碱;⑤用米汤直接检验食用盐中是否含有碘元素;⑥用酸式滴定管量取20.00mL高锰酸钾酸性溶液;⑦用溴的四氯化碳溶液除去混在甲烷中的乙烯气体.
- A.⑥⑦
- B.②⑥
- C.⑤⑥⑦
- D.只有⑥