网址:http://m.1010jiajiao.com/timu_id_155088[举报]
一、单项选择题(本题包括16小题,每小题3分,共48分)
1、B 2、D 3、B 4、A 5、D 6、A 7、A 8、C
9、B 10、A 11、C 12、B 13、B 14、B 15、B 16、D
二、(本题包括2小题,共40分)
17。(3分)①②⑤⑥
18.(13分)(1)铜锌及浓盐酸一起组成了原电池,加快了反应速率(2分)
(2)①没道理,因为H2本身难溶于水(2分)
②(2分)
将铜片加入稀硫酸中,并微热
若无气体放出,则不含锌等活泼金属杂质;若有气体则有锌等杂质
(3)(5分)
白色沉淀是氯化亚铜
向白色沉淀中加入稀HNO3等强氧化剂
溶液变蓝色,说明是一价铜
向氯化亚铜悬浊液中加入氯化钾溶液
如白色沉淀消失且得无色溶液,则原溶液为氯化亚铜,否则不是
 (4)[CuCl4]3-(aq) CuCl(s) +
3Cl-(aq) (2分)
(4)[CuCl4]3-(aq) CuCl(s) +
3Cl-(aq) (2分)
19.(12分)
(1) (2分)
(2分)
(2)Cl2+H2O2==2HCl+O2(2分)
(3)-2、+4、+6(2分)
(4)Al2Te3+6H2O==2Al(OH)3↓+3H2Te↑(或其它合理答案(2分)
(5)Se(2分)O2(2分)
20.(12分)(1)使Al3+、Fe3+完全沉淀(2分)
(2)Ca2++(NH4) CaC2O4↓+2NH4+(2分)
(3)Fe(OH)3、Al(OH)3(各1分,共2分)
(4)Fe3++3SCN― Fe(SCN)3(写成其它正确的络合离子形式给分,2分)
(5)使Fe3+转化为Fe(OH)3沉淀;检验Al3+(或铝元素)存在。(各2分,共4分)
三、(本题包括1小题,共12分)
21。⑴解法一:由反应的化学方程式得知,反应掉的N2和生成NH3的物质的量之比为1∶2,设反应掉的N2的物质的量为x mol。则 x∶6 = 1∶2 解之x =
 解法二: N2 + 3H2 2NH3
解法二: N2 + 3H2 2NH3
开始时 a b 0
t时13
6
在t时生成 6 mol NH3,消耗了3 mol N2,所以a = 13 + 3 = 16
⑵n平(NH3) =
⑶5∶4 ⑷2∶3 ⑸1∶2 ⑹ 3∶3∶2
(各2分,共12分)
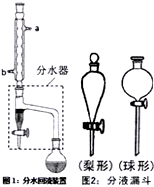 实验室制备乙酸正丁酯的化学方程式:
实验室制备乙酸正丁酯的化学方程式:CH3COOH+CH3CH2CH2CH2OH
| 浓H2SO4 |
| △ |
制备过程中还可能的副反应有:
CH3CH2CH2CH2OH
| 浓H2SO4 |
| △ |
主要实验步骤如下:
①在干燥的圆底烧瓶中加11.5mL正丁醇、7.2mL冰醋酸和3~4滴浓H2SO4,摇匀后,加几粒沸石,再如图1装置安装好分水器、冷凝管.然后小火加热.
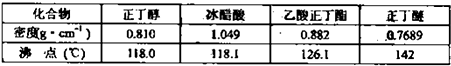
②将烧瓶中反应后的混后物冷却与分水器中的酯层合并,转入分液漏斗,③依次用10mL水,10mL 10%碳酸钠溶液洗至无酸性(pH=7),再水洗一次,用少许无水硫酸镁干燥.④将干燥后的乙酸正丁酯转入50mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品.主要试剂及产物的物理常数:
根据以上信息回答下列问题.
(1)图1装置中冷水应从
(2)在步骤①④中都用到沸石防暴沸,下列关于沸石的说法正确的是
A.实验室沸石也可用碎瓷片等代替 B.如果忘加沸石,可速将沸石加至将近沸腾的液体中
C.当重新进行蒸馏时,用过的沸石可继续使用 D.沸石为多孔性物质,可使液体平稳地沸腾
(3)在步骤③分液时,分液漏斗旋塞的操作方法与酸式滴定管的是否相同
(4)在提纯粗产品的过程中,用碳酸钠溶液洗涤主要除去的杂质
(5)步骤④的常压蒸馏,需收集
已知:草酸铵(NH4)2C2O4属于弱电解质.草酸钙难溶于水,Ca2+、Al3+、Fe3+完全沉淀分别pH:pH≥13;pH≥5.5;pH≥4.1;
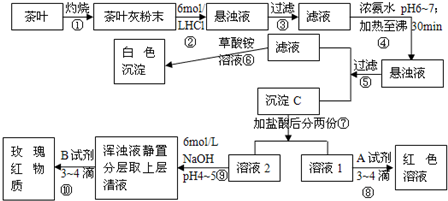
根据上述过程及信息填空.
(1)步骤②加盐酸的作用是______
(2)写出检验Ca2+的离子方程式______
(3)写出沉淀C所含主要物质的化学式______
(4)写出步骤⑧中加入A试剂生成红色溶液的离子方程式______
(5)步骤⑨的作用是______.
(16 分)某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有钙、铁、铝三种金属元素。
【查阅资料】:草酸铵![]() 属于弱电解质:草酸钙
属于弱电解质:草酸钙![]() 难溶于水;
难溶于水;![]() 、
、![]() 、
、![]() 完全沉淀的pH;
完全沉淀的pH;![]() :
:![]() ;
;![]() ;
;![]() 。
。
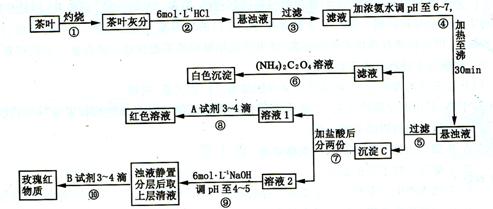
试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是__________________________。
(2)写出检验![]() 的离子方程式______________________________。
的离子方程式______________________________。
(3)写出沉淀C所含主要物质的化学式________________________。
(4)写出步骤⑧用A试剂生成血红色溶液的离子方程式____________________。
(5)步骤⑨的作用是__________,发生反应的离子方程式____________________。
(6)猜测步骤⑩的目的是____________________________。
(7)已知:![]() ,
,![]() ;
;![]() ;
;![]() ,则
,则![]() _______
_______![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。

[ Cu(NH3)4]SO4·H2O=[ Cu( NH3)4]2++SO42-+H2O
[Cu(NH3)4]2+
 Cu2++4NH3②(NH4)·SO4在水中可溶,在乙醇中难溶。
Cu2++4NH3②(NH4)·SO4在水中可溶,在乙醇中难溶。③[ Cu( NH3)4]SO4·H2O在乙醇一水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如下

方案l的实验步骤为: a.加热蒸发,b.冷却结晶,c.抽滤,d.洗涤,e.干燥
(1)①步骤c的抽滤装置如下图所示,该装置中的错误之处是____;抽滤完毕或中途需停止抽滤时,应先______,然后________。
②该方案存在明显缺陷,因为得到的产物晶体中往往含有____杂质,产生该杂质可能的原因是______ 。
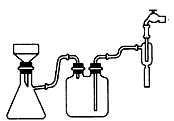
(2)a向溶液C中加入适量______,b_______,c.洗涤,d.干燥。
①请在上述空格内填写合适的试剂或操作名称。
(3) ②下列选项中,最适合作为步骤c的洗涤液是____。
A.乙醇 B.蒸馏水 C.乙醇和水的混合液 D.饱和硫酸钠溶液
③步骤d不宜采用加热干燥的方法,可能的原因是__________。
一水硫酸四氨合铜(Ⅱ)的化学式为[Cu(NH3)4]SO4·H2O是一种重要的染料及农药中间体。某学习小组在实验室以氧化铜为主要原料合成该物质,设计的合成路线为:

相关信息如下:
①[Cu(NH3)4]SO4·H2![]() O在溶液中存在以下电离(解离)过程:
O在溶液中存在以下电离(解离)过程:
[Cu(NH3)4]SO4·H2O=[Cu(NH3)4]2++![]() +H2O
+H2O
![]()
②(NH4)2SO4在水中可溶,在乙醇中难溶。
③[Cu(NH3)4]SO4·H2O在乙醇·水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如![]() 下:
下:
 请根据以下信息回答下列问题:
请根据以下信息回答下列问题:
(1)方案1的实验步骤为:
a. 加热蒸发 b. 冷却结晶 c. 抽滤 d. 洗涤 e. 干燥
①步骤C的抽滤装置如下图所示,该装置中的错误之处是 ;抽滤完毕或中途需停止抽滤时,应先 ,然后 。
②该方案存在明显缺陷,因为得到的产物晶体事往往含有 杂质,产生该杂质的原因是 。

(2)方案2的实验步骤为:
a. 向溶液C加入适量 ,b. ,c. 洗涤,d. 干燥。
①请在上述空格内填写合适的试剂或操作名称。
②下列选项中,最适合作为步骤c的洗涤液是 。
A. 乙醇 B. 蒸馏水 C. 乙醇和水的混合液 D. 饱和硫酸钠溶液
③步骤d不宜采用加热干燥的方法,可能的原因是 。
查看习题详情和答案>>