2008-2009高三第一次调考化学试卷
本试卷分为第1卷(选择题)和第Ⅱ卷(非选择题)两部分。共100分,时间90分钟。
注意事项:
1.所有答案均写在第II卷上。
2.答题前,考生务必将自己的“姓名”、“班级”和“学号”“座号”写在相应的位置上;
3.考试结束,只交答题卡和第II卷。
4.可能用到的原子量:H-1;O-16;N-14;Al-27;S-32;Na-23
Ⅰ卷
一.选择题(本题包括17小题,每小题3分,共51分,每小题只有一个选项符合题意)
1.下列反应不属于氧化还原反应是是:
A.Cl2 + H2O == HClO + HCl B.3CO + Fe2O3 = 2Fe + 3CO2
C. CaCO3 + SiO2 == CaSiO3+CO2
D.3CuS + 8HNO3 = 3Cu(NO3)2 + 2NO + 2S +4 H2O
2.“和平使命―
A.能全部透过半透膜 B.有丁达尔现象
C.所得物质属于纯净物 D.所得物质一定是浊液
3.下列说法中正确的是
①离子化合物中可能含有共价键,②构成单质分子的微粒一定含有共价键,③共价化合物中可能含有离子键,④由非金属元素组成的化合物不一定是共价化合物,⑤离子化合物中只含有离子键, ⑥不同的三种元素组成的多原子化合物中一定有离子键,⑦共价化合物中不含有离子键,⑧两个非金属原子间不可能形成离子键
A. ①④⑦⑧ B. ②③⑤⑥ C. ①②⑤⑧ D. ③④⑥⑦
4.以NA表示阿伏加德罗常数,下列说法中正确的是
A..电解食盐水若产生
B.0.1molNa与O2气在一定条件下生成和Na2O和Na2O2混合物时,失去的电子数为0.1NA
C
D.标准状况下
5.下列说法错误的是
A、原子晶体中只存在非极性共价键
B、分子晶体的状态变化,只需克服分子间作用力
C、金属晶体通常具有导电、导热和良好的延展性
D、离子晶体在熔化状态下能导电
6.下列物质性质的变化规律,与共价键的键能大小有关的是
A.F2、Cl2、Br2、I2的熔点、沸点逐渐升高
B.HF的沸点比HCl、HBr、HI的沸点要高
C.金刚石的硬度、熔点、沸点都高于晶体硅
D.NaF、NaCl、NaBr、NaI的熔点依次降低
7.向含有下列离子的溶液中,通入适量的氯气会引起离子浓度减少的是
① ②
② ③OH- ④Fe2+
③OH- ④Fe2+
A.①② B. ③④ C. ①②③ D. ①②③④
8.下列反应中,改变反应物用量或浓度,不会导致反应产物改变的是
A.CO2通入氢氧化钠溶液 B.硫酸中加入锌粉
C.盐酸与偏铝酸钠溶液反应 D.铁粉在硫蒸气中燃烧
9.下列离子方程式书写正确的是( )
A.在氯化铝溶液中加入过量氨水 Al3++3OH-==Al(OH)3↓
B.在硫酸铜溶液中加入过量氢氧化钡溶液 Ba2++ ==BaSO4↓
==BaSO4↓
C.在澄清石灰水中通入过量二氧化碳 OH-+CO2==
D.在碳酸氢钙溶液中加入过量氢氧化钠溶液
Ca2++ +OH-==CaCO3↓+H2O
+OH-==CaCO3↓+H2O
10.下列反应离子方程式正确的是
A.大理石溶于醋酸溶液: CaCO3 + 2H+==Ca2+ + CO2 ↑+ H2O
B.氯气通入冷的氢氧化钠溶液中: 2Cl2 + 2OH- = 3Cl- + ClO-+ H2O
C.向澄清石灰水中加入少量小苏打溶液: Ca2+ + OH-+ HCO3- =CaCO3↓+ H2O
D.氨水中通入过量二氧化硫: 2NH3?H2O + SO2 = 2NH4+ + SO32-+ 2H2O
11.下图是电解饱和NaCl溶液的实验装置, X、Y都是惰性电极, a是饱和NaCl溶液, 同时在两边各滴入几滴酚酞试液,下列有关该实验正确的说法是
 A.X电极为阳极,Y电极为阴极
A.X电极为阳极,Y电极为阴极
B.X电极附近溶液变红色,且有刺激性气味气体产生
C.若将两电极产生的气体收集起来,X电极得到的气体与Y电极得到的气体之比略大于1:1
D.电解后,将溶液混匀,电解前后溶液的pH未发生变化
12.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行: Cd(OH)2+2Ni(OH)2 Cd+2NiO(OH)+2H2O。由此可知,该电池放电时的负极材料是( )
Cd+2NiO(OH)+2H2O。由此可知,该电池放电时的负极材料是( )
A.Cd(OH)2 B.Ni(OH)2 C.Cd D.NiO(OH)
13.
A.C(s)+ O2(g)==CO(g);△H=-393.5 kJ/mol
O2(g)==CO(g);△H=-393.5 kJ/mol
B.2H2(g)+O2(g)==2H2O(g);△H=+571.6 kJ/mol
C.CH4(g)+2O2(g)==CO2(g)+2H2O(g);△H=-890.3 kJ/mol
D. C6H12O6(s)+3O2(g)
=== 3CO2(g)+3H2O(1);△H=-1400 kJ/mol
C6H12O6(s)+3O2(g)
=== 3CO2(g)+3H2O(1);△H=-1400 kJ/mol
14.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是:( )
A.电解饱和MgCl2溶液

B.过量氯气通入溴化亚铁溶液中
3Cl2+2Fe2++4Br_====6Cl-+2Fe3++2Br2?
C.向沸水中滴加饱和的氯化铁溶液制氢氧化铁胶体
Fe3+ + 3H2O = Fe(OH)3 ↓+ 3H+
D
15.在锌和很稀的硝酸充分反应,当消耗锌与硝酸的物质的量比为1:2.5时,除生成硝酸锌和水之外还生成另一种物质,该物质可能是( )
①NO2 ②.N2O ③.NO ④.NH4NO3
A.①② B.①③ C.②④ D.③④
16.向含有0.078molFeCl2的溶液中通入0.009molCl2,再向其中加入含0.01molX2O72-的酸性溶液,使溶液中的Fe2+恰好完全被氧化,且X2O72-被还原为Xn+,则n值为:( )
A.2
B.
17.Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1:1时,实际参加反应的Cu2S与HNO3的物质的量之比为( )
A.1:7 B.1:9 C.1:5 D.2:9
选择题答题卷


 题号
题号
1
2
3
4
5
6
7
8
9
答案
题号
10
11
12
13
14
15
16
17
答案
Ⅱ卷
三、填空题(本题包括5个小题,共49分)
18.(9分)⑴、
甲醇的燃烧热为:________________________;
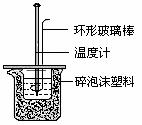
(2)、实验室用50 mL0.50 mol/L盐酸、50 mL0.55 mol/LNaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:
实验次数
起始温度t1/℃
 终止温度
终止温度
t2/℃
盐酸
NaOH溶液
1
20.2
20.3
23.7
2
20.3
20.5
23.8
3
21.5
21.6
24.9
试回答下列问题:
①、实验时用环形玻璃棒搅拌溶液的方法是_________________________________,
不能用铜丝搅拌棒代替环形玻璃棒的理由是_____________________________。
②、经数据处理,t2-t1=
(盐酸和NaOH溶液的密度按
③、若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:ΔH1____________ΔH(填“<”、“>”或“=”),理由是________________________________________________________。
19.(10分)A、B、C、D、E均为短周期元素,且原子序数逐渐增大。A、D同主族,A与B的质子数之和等于C的质子数,A+离子与C2- 离子的核外电子数之和等于D+离子的核外电子数,B原子与D+离子的核外电子数之和等于E原子的核外电子数。
(1)、A、B、C、D、E的元素符号分别为________________________。
(2)、D、E元素可组成化合物甲,电解甲的水溶液时,反应的离子方程式为_____________________________________;A、C元素可组成原子个数比为1∶1的化合物乙,将E单质通入乙的水溶液中,生成一种强酸,并有气体放出,反应的化学方程式为_________________________________。
(3)A、B、C、E中的任意三种元素可组成多种化合物,其中既含离子键又含共价键,且水溶液呈酸性的化合物有__________________________。
(4)A、C、D、E中的任意三种元素可组成多种化合物,其中溶于水时能抑制水电离的化合物有(各写一种不同类别的化合物)____________________,它们能抑制水电离的理由是_____________________________________________。
20.(12分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。
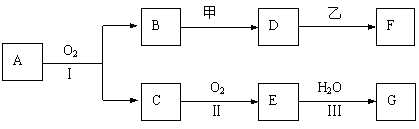 |
⑴若A为黄色固体,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则
|
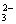 、NO
、NO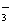 、SO
、SO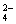 两两组合而成,它们的溶液发生如下反应:
两两组合而成,它们的溶液发生如下反应: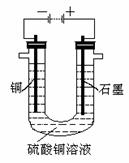 22.(9分)
22.(9分) 2Fe2O3+8SO2(2分)
2Fe2O3+8SO2(2分)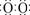 ]2-Na+ ( 2分)
]2-Na+ ( 2分) 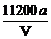 (2分)
(2分)