网址:http://m.1010jiajiao.com/timu_id_113835[举报]
(共11分)如图为某化学兴趣小组进行丁烷裂解的实验流程。(注:CuO能将烃氧化成CO2和H2O,G后面装置与答题无关,省略。)
按图连接好装置后,需进行的实验操作有:①给D、G装置加热;②检查整套装置的气密性;③排出装置中的空气……
(1)这三步操作的先后顺序依次是 。
(2)简要说明排空气的方法和证明空气已排尽的方法 。
(3)B装置所起的作用是 。
(4)若对E装置中的混和物再按以下流程实验:
①分离操作I、II的方法是:I ,II 。
②Na2SO3溶液的作用是(用离子方程式表示)
。
(5)假定丁烷完全裂解,流经各装置中的气体能完全反应。当(E和F)装置的总质量比反应前增加了1.82g,G装置中固体质量减少了4.16g,则丁烷的裂解产物中:n(CH4):n(C2H6)=
(共11分)抗击“非典”期间,过氧乙酸(CH3COOOH)是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
①□MnO4-+□H2O2+□H+ =□Mn2++□O2↑十□H2O
②H2O2+2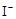 +2H+ = I2+2H2O
+2H+ = I2+2H2O
③CH3COOOH+2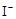 +2H+ = CH3COOH+I2+H2O[来源:学§科§网]
+2H+ = CH3COOH+I2+H2O[来源:学§科§网]
④I2 + 2S2O32- =2I- + S4O62-
请回答以下问题:
(l)配平反应①的离子方程式(配平系数填入以下方框内):
□MnO4-+□H2O2+□H+ = □Mn2++□O2↑十□H2O
(2)用单线桥法在下面已配平的化学方程式上标出电子转移的方向和数目:
□MnO4-+□H2O2+□H+ = □Mn2++□O2↑十□H2O
(3)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是____________________。
(4)取b0 L待测液,用硫酸使溶液酸化,再用浓度为a1 mol·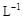 的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 L(反应①,滴定过程中KMnO4不与过氧乙酸反应)。另取b0 L待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·
的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 L(反应①,滴定过程中KMnO4不与过氧乙酸反应)。另取b0 L待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·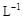 的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 L。请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。c0= _______________ mol·
的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 L。请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。c0= _______________ mol·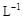 。
。
(5)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是否影响测定结果 ________(填是或否)
查看习题详情和答案>>
实验室里用固体烧碱配制500mL0.12mol/L的NaOH溶液。(本题共11分)
⑴.需称取 g的固体烧碱,为防止发生因潮解而沾粘,固体应放在 中
然后置于托盘天平上称量。
⑵.配制过程中要用到的仪器有 。(写出四种即可)
⑶.在容量瓶内确定溶液体积的过程中,完成后期加入少量水的操作是 _____
_________________________________。
⑷.如所得NaOH溶液的密度为1.2g/cm3,则该溶液中NaOH的质量分数是 。
⑸.下列各项中,可能导致实际浓度偏高的是 。(填标号)
A.在托盘天平上垫纸,将NaOH放在纸上称量。
B.NaOH溶解是会放出大量的热,未等冷却就立即配制溶液
C.NaOH溶液转移到容量瓶后,溶解NaOH的烧杯和玻璃棒未洗涤
D.NaOH溶液转移到容量瓶的过程中不慎洒出
查看习题详情和答案>>
(共11分).某反应中反应物与生成物有: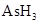 、
、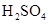 、
、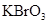 、
、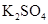 、
、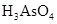 、
、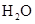 和一种未知物质X。(1)已知
和一种未知物质X。(1)已知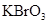 在反应中得到电子,则该反应的还原剂是
。(2)已知0.2mol
在反应中得到电子,则该反应的还原剂是
。(2)已知0.2mol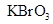 在反应中得到1mol电子生成X,则X的化学式为
。(3)根据上述反应可推知
。
在反应中得到1mol电子生成X,则X的化学式为
。(3)根据上述反应可推知
。
a.氧化性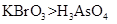 b.氧化性:
b.氧化性: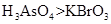
c.还原性: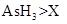 d.还原性:
d.还原性: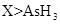
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:
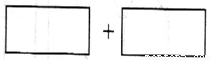
查看习题详情和答案>>
(共11分) 课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
(1)电源A 极的名称是___________
(2)乙装置中电解反应的总化学方程式是________________
(3)如果收集甲、乙装置中C、D、E、F产生的物质的物质的量之比是________
(4)欲用丙装置给铜镀银,G应该是_____(填名称),电镀液的主要成分是______(填化学式)
(5)装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带_________电荷。
(6)从Cu2+、Na+、SO42-、Cl-四种离子中恰当地组成电解质,按下列要求进行电解,
写出所有符合要求的物质化学式。
①、以石墨为电极进行电解,使电解质质量减少,水质量不变,采用的电解质是________
②、以石墨为电极进行电解,使电解质质量不变,水质量减少,采用的电解质是________
③、以碳棒为阳极,铁棒为阴极进行电解,使电解质和水的质量都减少,采用的电解质是___
查看习题详情和答案>>