江苏省泰兴中学高三化学高考冲刺卷
可能用到的相对原子质量:H―1 O―16 Cu―64 N―14 C―12 Zn―65
单项选择题:本题包括8小题,每小题3分,共计24分。每小题只有一个选项符合题意。
1.
A、铂纳米晶体在火焰上灼烧呈无色
B、氨气催化氧化中铂纳米晶体的催化效率比普通铂丝大
C、铂丝可以作为燃料电池负极,可燃气体在负极上发生氧化反应
D、铂纳米晶体与硝酸反应,而铂不溶于硝酸
2、下列有关说法不正确的是
A.能使品红试液褪色的气体不一定是SO2
B.胶黏剂UF结构为: ,可推测其单体为尿素和甲醇
,可推测其单体为尿素和甲醇
C.CO2电子式为
D. 命名为4-甲基-2-戊烯
命名为4-甲基-2-戊烯
3、下列实验装置设计正确,且能达到目的的是:


4、在下列溶液中,各组离子可能大量共存的是
A.使pH试纸呈红色的溶液中:Fe2+、ClO-、SO42-、Na+
B.加入铝粉后产生大量氢气的溶液中:NH4+、Na+、NO3-、SO42-
C.由水电离出c(H+)=10-12 mol?L-1的溶液:K+、Al3+、Cl-、SO42-
D.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
5、Na2 FeO4是一种高效多功能水处理剂,应用前景广阔。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2 O2=2Na2 FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是
A.Na2O2在反应中只作氧化剂 B.Na2FeO4既是氧化产物又是还原产物
C.O2是还原产物 D.2 mol FeSO4发生反应时,反应中共有8 mol电子转移
6、为探究钢铁的吸氧腐蚀原理设计了如图所示装置,下列有关说法中错误的是
 A.正极的电极方程式为:O2 + 2H2O
+ 4e_ = 4OH _
A.正极的电极方程式为:O2 + 2H2O
+ 4e_ = 4OH _
B.将石墨电极改成Mg电极,难以观察到铁锈生成
C.若向自来水中加入少量NaCl(s),可较快地看到铁锈
D.分别向铁、石墨电极附近吹入O2,前者铁锈出现得快
7、对下列实验现象的分析,结论正确的是
编 号
实验现象
结 论
甲溶液中加入氯化钡、稀硝酸的混合液
产生白色沉淀
甲溶液中一定含有SO42-或SO32-
乙溶液进行焰色反应
焰色呈黄色
乙一定是钠盐溶液
丙溶液中加入硝酸银、稀硝酸的混合液
产生白色沉淀
丙溶液中一定有Cl-
把湿润的碘化钾―淀粉试纸放入红棕色的丁气体中
试纸变蓝色
丁不一定是溴蒸气
8、A、B、C为第二、第三周期的元素,A、B在同周期,A、C最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构。下列说法中,正确的是
 A.原子核外最外层电子数:A>C>B
B.离子半径:A2->B2+>C-
A.原子核外最外层电子数:A>C>B
B.离子半径:A2->B2+>C-
C.B和C形成化合物的电子式为B2+[:C:]2 D.沸点:HC > H
不定项选择题:本题包括6小题,每小题4分,共计24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
9.NA代表阿伏加德罗常数,下列说法正确的是
A. pH为3的FeCl3溶液中,由水电离产生的H+离子数目为0.001NA
B.乙烯和丙烯的混合物
C.标准状况下,
D.0.1mol甲基(-CH3)所含电子数为0.8NA
10、下列离子方程式或化学方程式中正确的是
A.向Fe(OH)3中加入大量的氢溴酸:Fe(OH)3+3H+ = Fe3++3H2O
B.H218O中投入Na2O2固体: 2H218O+2Na2O2 ==4NaOH+18O2↑
C.往明矾溶液中加入氢氧化钡溶液至SO42_完全沉淀
Al3+ + 2SO42_ + 2 Ba2+ + 4OH- ==AlO2- + 2BaSO4↓+ 2H2O
D.硫酸氢铵稀溶液中滴加少量Ba(OH)2溶液:
Ba2+ + 2OH- + SO42_ + H+ + NH4+ ==BaSO4↓+ H2O + NH3?H2O
11、2008年诺贝尔化学奖授予美籍华裔钱永健等三位科学家,以表彰他们发现和研究了绿色荧光蛋白。荧光素是发光物质的基质, 5-羧基荧光素与5-羧基二乙酸荧光素在碱性条件下有强烈的绿色荧光,它们广泛应用于荧光分析等。 学科网
学科网 学科网
学科网

|
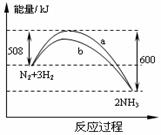 12、在一定温度时,N2与H2反应过程中能量变化的曲线如右图。下列叙述正确的是
12、在一定温度时,N2与H2反应过程中能量变化的曲线如右图。下列叙述正确的是 2NH3 △H=-92kJ/moL
2NH3 △H=-92kJ/moL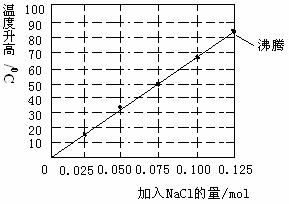
 提供的装置:
提供的装置: 模拟尾气的处理
模拟尾气的处理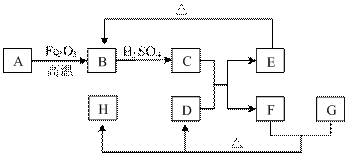
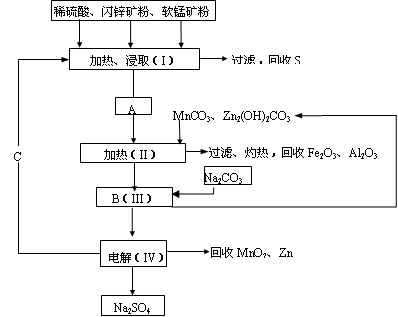 (2)MnCO3、Zn2(OH)2CO3的作用是_____________________________;II需要加热的原因是___________;C的化学式是____________。
(2)MnCO3、Zn2(OH)2CO3的作用是_____________________________;II需要加热的原因是___________;C的化学式是____________。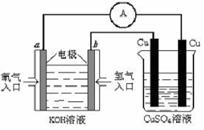
 2NH3(g);ΔH= -92.2 kJ?mol-1。
2NH3(g);ΔH= -92.2 kJ?mol-1。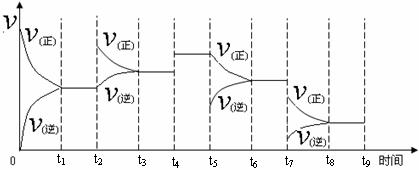
 H2(g) + CO(g) △H = +131.3 kJ/mol
H2(g) + CO(g) △H = +131.3 kJ/mol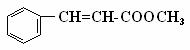 )常用于调制具有草莓、葡
)常用于调制具有草莓、葡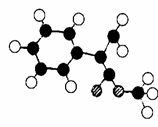 (3)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如
(3)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如 ?
? (4)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A~D图中正确的是 。
(4)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A~D图中正确的是 。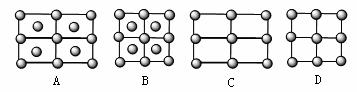
 球,镍原子用大
球,镍原子用大 球,镁原子用大
球,镁原子用大 球
球 (3) (1分)
(3) (1分) (2分)
(2分) (2分)
(2分) 2Cu2O+3H2O↑+SO3↑+O2↑………
2Cu2O+3H2O↑+SO3↑+O2↑……… 21、A(1)
21、A(1)  (2分)
(2分)