网址:http://m.1010jiajiao.com/timu_id_76815[举报]
题号
1
2
3
4
5
6
7
8
答案
D
B
A
C
B
D
D
D
题号
9
10
11
12
13
14
答案
B
AC
CD
B
BD
AB
15、(1)2xCO + 2NOx ==== 2xCO2 + N2 (2分),
(2)步骤一、NH3的制取
① H(1分)
② f(1分)
因为NH4Cl受热易分解,生成的部分NH3和HCl又重新结合成NH4Cl(1分);
而用NaOH或Ca(OH)2作反应物产生的水较多,吸收的NH3较多(1分)。(意思
相近均给分)
步骤二、模拟尾气的处理
① 3Cu + 8H+ + 2NO3? == 3Cu2+ + 2NO↑ + 4H2O(2分)
② 防止氨气溶解(或防止倒吸) (1分)
③ c(1分)
④未反应的NO无法处理,会污染环境(1分)
16.(8分)⑴NH3;⑵2Al+Fe2O32Fe+Al2O3;
⑶2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
Al(OH)3+OH-=AlO2-+2H2O(每空2分)
17、(1)MnSO4;(2)增大溶液的pH,使Fe3+和 Al3+生成沉淀; 使形成胶体的氢氧化铝和氢氧化铁也生成沉淀; H2SO4;(3)Fe2O3、Al2O3、S ;(4)纯碱 、H2SO4;(5)降温结晶;(6)1.03(或1)
18、(1) H2 (g)+ 1/2 O2 (g)=H2O (l) △H = -285.8 kJ /mol
(2) H2 -2 e- +2OH- =2H2O (3)① t4~t5 ②
(4)B (每空2分,共10分 )
19、(1)C10H10O2 (1分) (2)A、C (2分)
 (3) (1分)
(3) (1分)
(4)①羧基、羟基 ②酯化反应“或取代反应”,(2分,各1分)
 (2分)
(2分)
③  (2分)
(2分)
20、(1)将绿色沉淀X用蒸馏水多次洗涤,至洗涤液中用BaCl2溶液检验不出SO42-后,用稀盐酸溶解绿色沉淀,此时再用BaCl2溶液检验,溶解液中有白色沉淀生成,则说明沉淀X中有SO42-……………………2分
(2)Cu2O+2H+=Cu+Cu2+ +H2O……………………2分
(3)因为Cu2O∶Cu=0.454∶0.128 可判断Y为Cu2O
根据硫酸铜溶液跟氢氧化钠溶液混合生成沉淀,可设沉淀组成为mCu(OH)2?nCuSO4,则有(98m+160n)∶144×(m+n) /2=0.454∶0.288
即可得m∶n=3∶1,所以X为3Cu(OH)2?CuSO4或Cu4(OH)6SO4………………2分
(4)4∶3…………………2分;Cu4(OH)6SO4 2Cu2O+3H2O↑+SO3↑+O2↑………
2Cu2O+3H2O↑+SO3↑+O2↑………
 21、A(1)
21、A(1)  (2分)
(2分)
(2) 6(1分) (1分)
(3) 分子晶体 (1分) bc (2分)
(4) A (2分)
(5) MgCNi3 (2分) 12 (1分)
氢气是工业上重要的原料。
(1)氢气用于工业合成氨 N2(g) + 3H2(g) ![]() 2NH3(g);ΔH = -92.2 kJ·mol-1。
2NH3(g);ΔH = -92.2 kJ·mol-1。
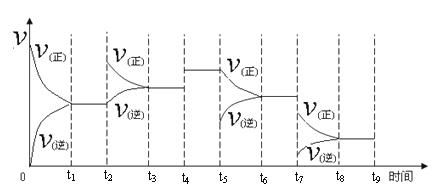
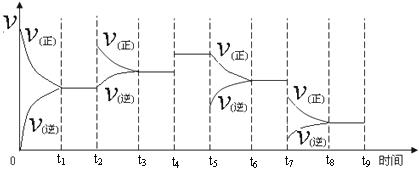
一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t4 ﹑t5 ﹑t7时刻所对应的实验条件改变分别是
t4 t5 t7 。
②温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪,此时放出热量46.1 kJ。则该温度下反应的平衡常数为 。
(2)工业上大量的氢气来源于焦炭与水蒸气高温下的反应:
C(s) + H2O(g) ![]() H2(g) + CO(g) △H = +131.3 kJ/mol
H2(g) + CO(g) △H = +131.3 kJ/mol
①该反应在低温下不能自发进行的原因是 。
②恒温,在容积可变的密闭容器中,进行如上可逆反应。一段时间后,下列物理量不发生变化时,能表明该反应已达到平衡状态的有:Ⅰ混合气体的密度;Ⅱ容器内气体的压强;Ⅲ混合气体的总物质的量; ⅣCO物质的量浓度 ( )
A.只有Ⅳ B.只有Ⅰ和Ⅳ C.只有Ⅱ和Ⅲ
D.Ⅰ、Ⅲ和Ⅳ E.都可以
(3)在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入amol及bmol碘化氢(a>b)待反应:2HI(g)![]() H2(g)+I2(g) 达到平衡后,平衡时I2的浓度c(I2)A c(I2)B ;平衡时HI的分解率αA αB ;平衡时H2在混合气体中的体积分数A B (填写“>”“<”“=”)
H2(g)+I2(g) 达到平衡后,平衡时I2的浓度c(I2)A c(I2)B ;平衡时HI的分解率αA αB ;平衡时H2在混合气体中的体积分数A B (填写“>”“<”“=”)
氢气是工业上重要的原料。
(1)氢气用于工业合成氨 N2(g)+ 3H2(g) 2NH3(g);ΔH= -92.2 kJ·mol-1。
① 一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t4 ﹑t5 ﹑t7时刻所对应的实验条件改变分别是
t4 t5 t7 。
②温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪,此时放出热量46.1 kJ。则该温度下反应的平衡常数为 。
(2)工业上大量的氢气来源于焦炭与水蒸气高温下的反应:
C(s) + H2O(g) H2(g)+ CO(g) △H = +131.3 kJ/mol
①该反应在低温下不能自发进行的原因是 。
②恒温,在容积可变的密闭容器中,进行如上可逆反应。一段时间后,下列物理量不发生变化时,能表明该反应已达到平衡状态的有:Ⅰ混合气体的密度;Ⅱ容器内气体的压强;Ⅲ混合气体的总物质的量; ⅣCO物质的量浓度 ( )
A.只有Ⅳ B.只有Ⅰ和Ⅳ C.只有Ⅱ和Ⅲ
D.Ⅰ、Ⅲ和Ⅳ E.都可以
(3)在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入amol及bmol碘化氢(a>b)待反应:2HI(g)H2(g)+I2(g) 达到平衡后,平衡时I2的浓度c(I2)A c(I2)B ;平衡时HI的分解率αA αB ;平衡时H2在混合气体中的体积分数A B (填写“>”“<”“=”)
查看习题详情和答案>>
氢气是工业上重要的原料。
(1)氢气用于工业合成氨 N2(g) + 3H2(g) 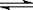 2NH3(g);ΔH =" -92.2" kJ·mol-1。
2NH3(g);ΔH =" -92.2" kJ·mol-1。
① 一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t4 ﹑t5﹑t7时刻所对应的实验条件改变分别是
t4 t5 t7 。
②温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪,此时放出热量46.1 kJ。则该温度下反应的平衡常数为 。
(2)工业上大量的氢气来源于焦炭与水蒸气高温下的反应:
C(s) + H2O(g) 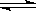 H2(g) + CO(g) △H =" +131.3" kJ/mol
H2(g) + CO(g) △H =" +131.3" kJ/mol
①该反应在低温下不能自发进行的原因是 。
②恒温,在容积可变的密闭容器中,进行如上可逆反应。一段时间后,下列物理量不发生变化时,能表明该反应已达到平衡状态的有:Ⅰ混合气体的密度;Ⅱ容器内气体的压强;Ⅲ混合气体的总物质的量; ⅣCO物质的量浓度 ( )
A.只有Ⅳ B.只有Ⅰ和Ⅳ C.只有Ⅱ和Ⅲ
D.Ⅰ、Ⅲ和Ⅳ E.都可以
(3)在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入amol及bmol碘化氢(a>b)待反应:2HI(g)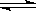 H2(g)+I2(g) 达到平衡后,平衡时I2的浓度c(I2)A c(I2)B ;平衡时HI的分解率αA αB ;平衡时H2在混合气体中的体积分数A B (填写“>”“<”“=”)
H2(g)+I2(g) 达到平衡后,平衡时I2的浓度c(I2)A c(I2)B ;平衡时HI的分解率αA αB ;平衡时H2在混合气体中的体积分数A B (填写“>”“<”“=”)
氢气是工业上重要的原料。
(1)氢气用于工业合成氨 N2(g)
+ 3H2(g) 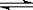 2NH3(g);ΔH
= -92.2 kJ·mol-1。
2NH3(g);ΔH
= -92.2 kJ·mol-1。
① 一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t4 ﹑t5 ﹑t7时刻所对应的实验条件改变分别是
t4 t5 t7 。
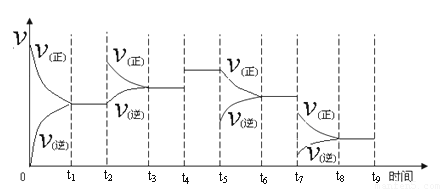
②温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪,此时放出热量46.1 kJ。则该温度下反应的平衡常数为 。
(2)工业上大量的氢气来源于焦炭与水蒸气高温下的反应:
C(s) + H2O(g) 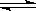 H2(g)
+ CO(g) △H = +131.3 kJ/mol
H2(g)
+ CO(g) △H = +131.3 kJ/mol
①该反应在低温下不能自发进行的原因是 。
②恒温,在容积可变的密闭容器中,进行如上可逆反应。一段时间后,下列物理量不发生变化时,能表明该反应已达到平衡状态的有:Ⅰ混合气体的密度;Ⅱ容器内气体的压强;Ⅲ混合气体的总物质的量; ⅣCO物质的量浓度 ( )
A.只有Ⅳ B.只有Ⅰ和Ⅳ C.只有Ⅱ和Ⅲ
D.Ⅰ、Ⅲ和Ⅳ E.都可以
(3)在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入amol及bmol碘化氢(a>b)待反应:2HI(g)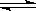 H2(g)+I2(g) 达到平衡后,平衡时I2的浓度c(I2)A
c(I2)B ;平衡时HI的分解率αA αB
;平衡时H2在混合气体中的体积分数A B (填写“>”“<”“=”)
H2(g)+I2(g) 达到平衡后,平衡时I2的浓度c(I2)A
c(I2)B ;平衡时HI的分解率αA αB
;平衡时H2在混合气体中的体积分数A B (填写“>”“<”“=”)
查看习题详情和答案>>
(12分)氢气是工业上重要的原料。
(1)氢气用于工业合成氨 N2(g) + 3H2(g) ![]() 2NH3(g);ΔH = -92.2 kJ·mol-1。
2NH3(g);ΔH = -92.2 kJ·mol-1。
一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t4 ﹑t5 ﹑t7时刻所对应的实验条件改变分别是
t4 t5 t7 。
 |
②温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪,此时放出热量46.1 kJ。则该温度下反应的平衡常数为 。
(2)工业上大量的氢气来源于焦炭与水蒸气高温下的反应:
C(s) + H2O(g) ![]() H2(g) + CO(g) △H = +131.3 kJ/mol
H2(g) + CO(g) △H = +131.3 kJ/mol
①该反应在低温下不能自发进行的原因是 。
②恒温,在容积可变的密闭容器中,进行如上可逆反应。一段时间后,下列物理量不发生变化时,能表明该反应已达到平衡状态的有:Ⅰ混合气体的密度;Ⅱ容器内气体的压强;Ⅲ混合气体的总物质的量; ⅣCO物质的量浓度 ( )
A.只有Ⅳ B.只有Ⅰ和Ⅳ C.只有Ⅱ和Ⅲ
D.Ⅰ、Ⅲ和Ⅳ E.都可以
(3)在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入amol及bmol碘化氢(a>b)待反应:2HI(g)![]() H2(g)+I2(g) 达到平衡后,平衡时I2的浓度c(I2)A c(I2)B ;平衡时HI的分解率αA αB ;平衡时H2在混合气体中的体积分数A B (填写“>”“<”“=”)
H2(g)+I2(g) 达到平衡后,平衡时I2的浓度c(I2)A c(I2)B ;平衡时HI的分解率αA αB ;平衡时H2在混合气体中的体积分数A B (填写“>”“<”“=”)