网址:http://m.1010jiajiao.com/timu_id_76797[举报]
题号
1
2
3
4
5
6
7
8
答案
D
B
A
C
B
D
D
D
题号
9
10
11
12
13
14
答案
B
AC
CD
B
BD
AB
15、(1)2xCO + 2NOx ==== 2xCO2 + N2 (2分),
(2)步骤一、NH3的制取
① H(1分)
② f(1分)
因为NH4Cl受热易分解,生成的部分NH3和HCl又重新结合成NH4Cl(1分);
而用NaOH或Ca(OH)2作反应物产生的水较多,吸收的NH3较多(1分)。(意思
相近均给分)
步骤二、模拟尾气的处理
① 3Cu + 8H+ + 2NO3? == 3Cu2+ + 2NO↑ + 4H2O(2分)
② 防止氨气溶解(或防止倒吸) (1分)
③ c(1分)
④未反应的NO无法处理,会污染环境(1分)
16.(8分)⑴NH3;⑵2Al+Fe2O32Fe+Al2O3;
⑶2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
Al(OH)3+OH-=AlO2-+2H2O(每空2分)
17、(1)MnSO4;(2)增大溶液的pH,使Fe3+和 Al3+生成沉淀; 使形成胶体的氢氧化铝和氢氧化铁也生成沉淀; H2SO4;(3)Fe2O3、Al2O3、S ;(4)纯碱 、H2SO4;(5)降温结晶;(6)1.03(或1)
18、(1) H2 (g)+ 1/2 O2 (g)=H2O (l) △H = -285.8 kJ /mol
(2) H2 -2 e- +2OH- =2H2O (3)① t4~t5 ②
(4)B (每空2分,共10分 )
19、(1)C10H10O2 (1分) (2)A、C (2分)
 (3) (1分)
(3) (1分)
(4)①羧基、羟基 ②酯化反应“或取代反应”,(2分,各1分)
 (2分)
(2分)
③  (2分)
(2分)
20、(1)将绿色沉淀X用蒸馏水多次洗涤,至洗涤液中用BaCl2溶液检验不出SO42-后,用稀盐酸溶解绿色沉淀,此时再用BaCl2溶液检验,溶解液中有白色沉淀生成,则说明沉淀X中有SO42-……………………2分
(2)Cu2O+2H+=Cu+Cu2+ +H2O……………………2分
(3)因为Cu2O∶Cu=0.454∶0.128 可判断Y为Cu2O
根据硫酸铜溶液跟氢氧化钠溶液混合生成沉淀,可设沉淀组成为mCu(OH)2?nCuSO4,则有(98m+160n)∶144×(m+n) /2=0.454∶0.288
即可得m∶n=3∶1,所以X为3Cu(OH)2?CuSO4或Cu4(OH)6SO4………………2分
(4)4∶3…………………2分;Cu4(OH)6SO4 2Cu2O+3H2O↑+SO3↑+O2↑………
2Cu2O+3H2O↑+SO3↑+O2↑………
 21、A(1)
21、A(1)  (2分)
(2分)
(2) 6(1分) (1分)
(3) 分子晶体 (1分) bc (2分)
(4) A (2分)
(5) MgCNi3 (2分) 12 (1分)
| A、称取4.0g NaOH固体放入100mL容量瓶中,可配制1.0mol?L-1 NaOH溶液 | B、利用核磁共振氢谱图可鉴别1-溴丙烷和2-溴丙烷 | C、用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3 | D、除去NaHCO3溶液中的少量Na2CO3,可加入Ca(OH)2溶液后再过滤 |
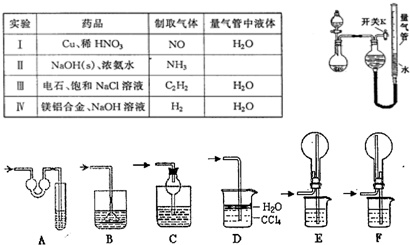
(1)实验过程中,使用分液漏斗滴加液体的操作是
(2)该同学认为实验I可通过收集并测量NO气体的体积来探究铜样品的纯度,你认为是否可行?
(3)实验Ⅲ烧瓶中发生反应的化学方程式是
(4)实验Ⅱ中量气管中的液体最好是
a.浓NaOH溶液 b.氨水 c.煤油 d.氯化铵溶液
该实验剩余的NH3需吸收处理.以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有
(5)本实验应对量气管多次读数,读数时应注意:①将实验装置恢复到室温,②
(6)实验Ⅳ获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响)
| 编号 | 镁铝合金度量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
(1)第一小组设计方案的流程如下:

①写出n (OH-)、n (Ca2+)与n (Na+)的关系:n(Na+)=
②设n (Na+)=x mol、n (Ca2+)=y mol,请填写下表:
| 碱石灰的 可能组成 |
NaOH、CaO | NaOH、CaO、 Ca (OH)2 |
NaOH、 Ca (OH)2 |
NaOH、 Ca (OH)2、H2O |
| n (Na+)、n (Ca2+) 的关系 |
40x+56y=4 | 40x+56y<4.0<40x+74y 40x+56y<4.0<40x+74y |
40x+74y=4.0 40x+74y=4.0 |
40x+74y<4.0 40x+74y<4.0 |
他们设计了如下方案并得出相关数据:取市售碱石灰4.0g,在250℃时加热至恒重,测得固体质量减少了0.42g,剩余固体在580℃时继续加热至恒重,固体质量又减少了0.75g.请通过计算确定该碱石灰各成分的质量分数.
已知:在氢氧化钠浓溶液中加入氧化钙,加热,制成的白色固体就是碱石灰.有两个实验小组的同学决定通过实验探究碱石灰的组成.
(1)第一小组设计方案的流程如下:

①写出n (OH-)、n (Ca2+)与n (Na+)的关系:n(Na+)=______.
②设n (Na+)=x mol、n (Ca2+)=y mol,请填写下表:
| 碱石灰的 可能组成 | NaOH、CaO | NaOH、CaO、 Ca (OH)2 | NaOH、 Ca (OH)2 | NaOH、 Ca (OH)2、H2O |
| n (Na+)、n (Ca2+) 的关系 | 40x+56y=4 | ______ | ______ | ______ |
他们设计了如下方案并得出相关数据:取市售碱石灰4.0g,在250℃时加热至恒重,测得固体质量减少了0.42g,剩余固体在580℃时继续加热至恒重,固体质量又减少了0.75g.请通过计算确定该碱石灰各成分的质量分数. 查看习题详情和答案>>
(1)第一小组同学设计的方案流程如下:

①写出n(OH-)、n(Ca2+)和n(Na+)的关系:n(Na+)=________________________。
②设n(Na+)=xmol、n(Ca2+)=ymol,请填写下表。

(2)第二小组同学查得如下资料:Ca(OH)2在250℃时不分解、NaOH在580℃时不分解。他们设计了如下方案并得出相关数据:取市售碱石灰4.0g,在250℃时加热至恒重,测得固体质量减少了0.6g,剩余固体在580℃时继续加热至恒重,固体质量又减少了0.7g。请通过计算确定该碱石灰中各成分的质量分数。 查看习题详情和答案>>