江苏省沭阳中学高三第三次调研
化学试卷
本试题可能用到的相对原子质量:H
一、单项选择题:(本题包括8小题,每题3分,共24分。每小题只有一个选项符合题意)
1.化学与生产、生活密切相关。下列说法中正确的是
A.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油”
B.废弃的塑料、金属、纸制品及玻璃都是可回收再利用的资源
C.凡含有食品添加剂的食物对人体健康均有害,不宜食用
D.钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水
2. 下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)===CO2(g);△H
②S(s)+O2(g)===SO2(g);△H3 S(g)+O2(g)===SO2(g);△H4
③H2(g)+O2(g)===H2O(l);△H5 2H2(g)+O2(g)===2H2O(l);△H6
④CaCO3(s)===CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)===Ca(OH)2(s);△H8
A.① B.④ C.②③④ D.①②③
3.下列有关工高考资源网业生产的叙述正确的是
A.工业制备镁和铝都采用电解熔融氧化物的方法
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室
D.CaCO3看用于炼铁、制水泥、制玻璃
4.阿伏加德罗常高考资源网数约为6.02×1023mol-1,下列说法中错误的是:
A.
B.
C.0.5 mol超重水(T2O)的质子总数约为5×6.02×1023
D.标准状况下,
5.下列反应对应的化高考资源网学用语正确的是:
A.卤素单质(X2)与水反应:X2+H2O==HXO+HX (X= F、Cl、Br)
B.FeS与足量稀硝酸反应:FeS+2H+==Fe2++H2S↑
 C.H218O中加入Na2O2固体:2H218O + 2Na2O2 4OH-
+ 18O2↑+4Na+
C.H218O中加入Na2O2固体:2H218O + 2Na2O2 4OH-
+ 18O2↑+4Na+
D.氢氧化亚铁溶于氢碘酸 Fe(OH)2+2H+==Fe2++H2O
6. 下列实验能达高考资源网到预期目的的是
A.为减小配制溶液的误差,容量瓶必须洗净并烘干后才能使用
B.向溶液中滴入盐酸有无色无味气体产生,则证明溶液中有CO32-
C.含有Mg(OH)2和Ca(OH)2的浊液中加入足量MgCl2,充分反应后过滤可除去Ca(OH)2
D.把纯净的铁和锌用导线连接一起插入到经过酸化的3%的NaCl溶液中,往铁电极区滴入2滴KSCN,有红色出现
7. 原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2-1.下列有高考资源网关x的说法中不正确的是
A.X能形成化学式为X(OH)3的碱
B.X可能形成化学式为KXO3的含氧酸钾盐
C.X原子的最外层电子数和核电荷数肯定为奇数
D.X能与某些金属元素形成化合物
8.在一定质量的硫酸溶液中加入氯化钡溶液直到反应完全,产生沉淀的质量与原硫酸溶液的质量相等,则原硫高考资源网酸溶液中H2SO4的质量分数为
A.42% B.36% C.30% D. 24%
二、不定项选择题(本题包括6小题,每小题4分,共24分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
9.下列离子方程式不正确的是高考资源网
A.将0.1 mol/L HCl溶液数滴缓缓滴入1mol/L50mL Na2CO3溶液中,且不断搅拌
2H++CO32-=CO2↑+H2O
B.4mol/L的NaAlO2溶液和7mol/L的HCl等体积互相均匀混合
4AlO2-+7H++H2O=3Al(OH)3↓+Al3+
C.在Mn2+的溶液中加入 HNO3再加入PbO2,则反应体系显紫红色
5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2H2O
D.硫酸亚铁酸性溶液中加入过氧化氢:4Fe2+ + 2H2O2 + 4H+ = 4Fe3+ + 4H2O
 10某无色气体X,可能含有CO2、SO2、HCl、HBr中的一种或几种。将X通过适量的氯水时,X恰好完全反应, ?有任何气体剩余。将所得的无色溶液分砚于两支?管后,
分?加入酸化的AgNO3 与BaCl2溶液,结果均高考资源网产生白色沉淀。下列推论正确的是:
10某无色气体X,可能含有CO2、SO2、HCl、HBr中的一种或几种。将X通过适量的氯水时,X恰好完全反应, ?有任何气体剩余。将所得的无色溶液分砚于两支?管后,
分?加入酸化的AgNO3 与BaCl2溶液,结果均高考资源网产生白色沉淀。下列推论正确的是:
A X中一定?有CO2 B X中一定有SO2,产生的沉淀是AgCl与BaSO4
C X中一定?有HBr D X中一定有HCl
11.结构简式如右图所示的物质是药物多巴的主要成分。下列对该物质的描述不正确的是
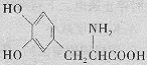 A.分别与氢氧化钠和盐酸反应,均生成盐
A.分别与氢氧化钠和盐酸反应,均生成盐
B.能发生加成、取代、缩聚、酯化等反应
C.1 mol该物质最多能和3 mol NaHCO3反应
D.该物质形成的蛋白质遇硝酸变黄色
12.今有两种正盐的稀溶高考资源网液,分别是a mol/LNaX溶液和b mol/LNaY溶液,下列说法不正确的是
A.若a=b,pH(NaX) >pH(NaY),则相同浓度时,酸性HX>HY
B.若a=b,并测得c(X-)=c(Y-)+c(HY),则HX是强酸,HY是弱酸
C.若a>b,测得c(X-)=c(Y-),则可推出溶液中c(HX)>c(HY),且相同浓度时,酸性
HX<HY
D.若两溶液等体积高考资源网混合,测得c(X-)+c(Y-)+c(HX)+c(HY)=0.1mol/L,则可推出
 a=b=0.1 mol/L
a=b=0.1 mol/L
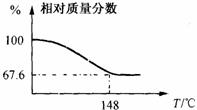
13.设计出燃料电池使汽油(设其成分为C5H12)氧化直接产生电流是21世纪最富有挑战性的课题之一。最近有人设计了一种固体燃料电池,固体氧化铝――氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如右图所示,其中多孔电极a、b均不参与电极反应。下列判断正确高考资源网的是
A.b极为电池的正极
B.b极对应的电极反应式为:
C5H12+16O2--32e-=5CO2+6H2O
C.该电池的总反应方程式为:C5H12+8O2+10OH-=5CO32-+11H2O
D.汽油燃料电池最大的技术障碍是氧化反应不完全,产生炭粒堵塞电极的气体通道,从而使输电效高考资源网能减弱
14.某温度下,在一密闭容器中发生如下可逆反应:2E(g)  F(g)+xG(g);△H<0。若起始时E浓度为a mol?L-1,F、G浓度均为0,达平衡时E浓度为O
F(g)+xG(g);△H<0。若起始时E浓度为a mol?L-1,F、G浓度均为0,达平衡时E浓度为O
A.升高温度时,正反应速率加快、逆反应速率减慢
B.若x=l,容器体积保持不变,新平衡下E的体积分数为50%
C.若x=2,容器体积保持不变,新平衡下F的平衡浓度小于0.
D.若x=2,容器压强保持不变,新平衡下E的物质的量为a mol
(非选择题 共72分)
三、(本题包括6高考资源网小题,共62分)
 15(12分)Na2CO3和H2O2结合成棒状晶体,Na2CO3?xH2O2(过氧化氢合相当于水合。注意:使用高浓度H2O2时一定要小心,防止爆炸生成水和氧气),可消毒、漂白或作O2源…。
15(12分)Na2CO3和H2O2结合成棒状晶体,Na2CO3?xH2O2(过氧化氢合相当于水合。注意:使用高浓度H2O2时一定要小心,防止爆炸生成水和氧气),可消毒、漂白或作O2源…。
现称取一定质量的Na2CO3?xH2O2晶体加热。实验结果以温度和相对质量分数示于右图。高考资源网
(1)该棒状晶体的化学式Na2CO3?xH2O2中x= 。
(2)加热过程中,在
a. Na2CO3?xH2O2分解放热 b.产生的H2O2分解放热
c. Na2CO3?xH2O2分解吸收热量小于产生的H2O2分解放出的热量
(3)事实上,Na2CO3?H2O2(x=1时)是Na2CO4?H2O(Na2CO4叫做过氧碳酸钠)。洗衣粉中加入适量的Na2CO4可以提高洗涤质量,其目的是对衣物进行漂白、消毒。试用化学方程式表示上述洗涤原理: 。高考资源网
(4)写出Na2CO4溶液与稀硫酸反应的离子方程式 。
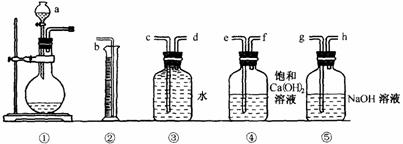 (5)商品过碳酸钠中一般都含有Na2CO3,为了测定它的纯度,常用下列仪器进行实验:取w g样品和足量盐酸反应后,测得仪器②中水的体积为a mL(该实验条件下气体的摩尔体积为Vm L?mol-1)。
(5)商品过碳酸钠中一般都含有Na2CO3,为了测定它的纯度,常用下列仪器进行实验:取w g样品和足量盐酸反应后,测得仪器②中水的体积为a mL(该实验条件下气体的摩尔体积为Vm L?mol-1)。
实验装置的连接顺高考资源网序为:a→ ,该样品中Na2CO4的质量分数为: 。
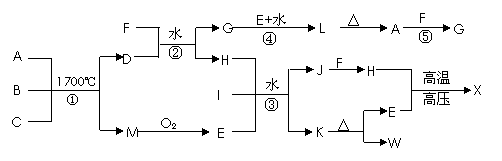 16(8分)下图是部分短周期元素的单质和化合物之间的相互转化关系,部分反应中的生成物没有全部列出。A为两性化合物,B、C是常见的非金属单质,D是由两种元素组成的新型陶瓷,F、I、K、w的焰色反应均为黄色,且I是厨房中常用的调味品。x是人类最早合成的有机物。反应③是工业生高考资源网产重要化工原料w的主要反应。
16(8分)下图是部分短周期元素的单质和化合物之间的相互转化关系,部分反应中的生成物没有全部列出。A为两性化合物,B、C是常见的非金属单质,D是由两种元素组成的新型陶瓷,F、I、K、w的焰色反应均为黄色,且I是厨房中常用的调味品。x是人类最早合成的有机物。反应③是工业生高考资源网产重要化工原料w的主要反应。
回答下列问题:
(1)写出x的分子式 。
(2)写出反应④高考资源网的离子方程式:_ ;
(3)反应①是工业合成D的方法之一,反应①的化学方程式为 。
(4)工业生产中反高考资源网应③的具体操作是:在I的饱和溶液中先通人H,再通人E。不先通 人E的原因是_________ 。
17(12分)绿色高考资源网化学的核心内涵是在反应过程中和化工生产中,尽量减少或彻底消除使用和产生有害物质。美国斯坦福大学Barry Trost教授提出了绿色化学下的原子经济的概念。最理想的原子经济是全部反应物的原子嵌入期望的最终产物中,不产生任何废弃物,这时的原子经济百分数便是100%。原子经济百分数的计算公式为:

回答下列有高考资源网关问题。
(1)下面叙述错误的是_________(填编号,下同)。
①绿色化学和环境化学都是研究环境保护和治理的
②绿色化学不是被动的治理环境,而是主动地防止环境污染
③绿色化学保护了环境,而且也能给有关企业带来巨大的经济利益
(2)硝酸工业的尾气中主要含NO、NO2气体。下列关于它们的危害的叙述中,正确的是_______________。
①形成酸雨 ②破坏臭氧层 ③NO能刺激呼吸道
④NO2能跟血红蛋白作用生成二氧化氮血红蛋白而引起中毒
⑤NO、NO2在空气中形成褐色或黄色的毒性很大的烟雾。
工厂里常采高考资源网用NaOH溶液吸收NO、NO2,使其转化为化工产品NaNO2,请写出其化学反应方程式 ,其原子经济百分数为 。
(3)“细菌冶金”是绿色化学思想的一种体现,其原理是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强。
① 该过程的化学反应方程式为 。
② 人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜,该过程中发生的离子反应高考资源网方程式(请补充完整并配平):
Cu2S+ Fe3++ H2O Cu2++ Fe2++ ( )+ SO42-
Cu2++ Fe2++ ( )+ SO42-
(4)有人将反应中产生的NO收集到一个固定容积的密闭容器中,并在常温下将其压缩到1.01×107 Pa,然后加热至
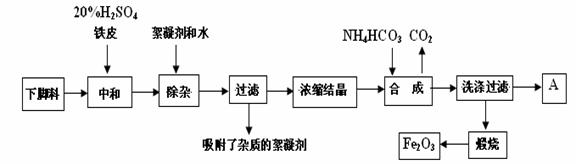
18(10分)磁材氧化铁的化学名称是氧化铁(Fe2O3),它是电子、电信工业的磁性材料,工业上采用生产钛白高考资源网粉的下脚料(含大量FeSO4的废液)为原料来制备磁材氧化铁。
已知煅烧中的化学反应方程式为:FeCO3 → FeO + CO2↑,4FeO + O2 → 2Fe2O3
(1)用98%的H2SO高考资源网4的配制500mL的20%的H2SO4,所需玻璃仪器是: 。
A、玻璃棒 B、烧杯 C、漏斗 D、250mL容量瓶
E、500mL容量瓶 F、胶头滴管
(2)A溶液中各离子的浓度比较大小为: 。
(3)20%H2SO4和铁皮高考资源网的作用分别是 。
(4)检验滤液中含有NH4+的方法是 。
(5)写出步骤“合成”中发生的化学变化(用化学方程式表示): 。
|
 19(12分)已高考资源网知:①CH3CH=C(CH3)2
CH3CHO+(CH3)
19(12分)已高考资源网知:①CH3CH=C(CH3)2
CH3CHO+(CH3)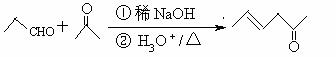
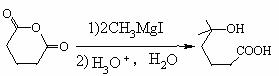
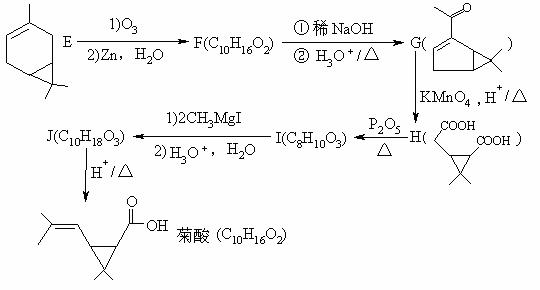

 (5)写出以
(5)写出以 为原料(无机试剂任选)合成H [ OCH(CH3)(CH2)4CO ]nOH流程图。
为原料(无机试剂任选)合成H [ OCH(CH3)(CH2)4CO ]nOH流程图。 三、
三、 2Fe2(SO4)3+2H2SO4(2分)
2Fe2(SO4)3+2H2SO4(2分) N2O4,即生成的NO2又双聚成N2O4,导致气体分子数减少,使其压强路小于1.01×107 Pa的2/3(1分)
N2O4,即生成的NO2又双聚成N2O4,导致气体分子数减少,使其压强路小于1.01×107 Pa的2/3(1分) (2分)(2)加成、消去 (2分)
(2分)(2)加成、消去 (2分)

