2006--2007学年度烟台市第一学期期末初四考试化学试卷
可能用到的相对原子质量:C:12 H:1 0:16 Ca:40
一、单项选择题:(每小题2分,共20分,每小题只有一个选项符合题意)
1.钾肥能增强作物对病虫害和倒伏的抵抗能力。下列属于钾肥的是 ( )
A.KCI B.Na2S04 C.NH4HC03 D.Ca(H2PO4)2
2.下列物质富含油脂的是 ( )
A.猪油 B.白糖 C.大米 D.苹果
3.生活中处处离不开化学,下列说法错误的是 ( )
A.长期饮用纯净水,不利于身体健康
B.经常咬铅笔,铅笔上的油漆对身体有害
C.经常食用腌制食品,有利于身体健康
D.经常使用染发剂,不利于身体健康
4.下列关于生活中常用材料的认识,正确的是 ( )
A.涤纶、羊毛和棉花都是天然纤维
B.各种塑料在自然界都不能降解
C.电木插座破裂后可以热修补
D.装食品用的聚乙烯塑料袋可以通过加热进行封口
5.世界每年产生有害废物达3亿吨-4亿吨,对环境造成危害,威胁着人类生存,所以科学家提出绿色化学概念。下列哪项不属于“绿色化学”研究的内容 ( )
A.绿色化学研究对环境无污染的清洁能源的开发
B.绿色化学研究可降解塑料的开发
C.绿色化学就是利用化学原理从源头消除污染
D.绿色化学研究形状记忆合金的开发与应用
6.考古发现,早在一万多年前我国已开始制造和使用陶器。现代人们已能生产新型陶瓷材料,如用氧化铝等为原料生产的陶瓷已制造发动机零件。下列有关氧化铝陶瓷的说法错误的是( )
A.该陶瓷属于无机非金属材料
B.该陶瓷中的原料氧化铝属于非金属氧化物
C.该陶瓷耐高温、强度高
D.该陶瓷耐酸、碱等化学物质的腐蚀
7.将下表内每一组无色溶液都能区别开来的试剂是 ( )
第一组
第二组
第三组
淀粉、氯化钠
淀粉、碳酸钠
淀粉、葡萄糖
A.碘水 B.酚酞试液 C.稀盐酸 D.石蕊试液
8.现代社会对能量的需求量越来越大。下图是利用不同形式的能量发电的示意图,其中属 于化学变化的是 ( )
A.燃烧化石燃料产生热量
B.水受热变为水蒸气
C.风力、水力、潮汐力、水蒸气带动涡轮机转动
D.发电机工作产生电能
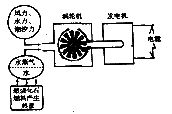
9.欲配制100kg溶质质量分数为7.1%的KN03溶液作无土栽培的营养液,需KN03的质量为 ( )
A.7.1kg B.14.2kg C.71kg D.96.9kg
lO.分析表中的数据,以下看法不可取的是 ( )
溶液种类
生理盐水
人体血液
30亿年前原始海水
含盐质量分数
0.9%
0.9%
0.9%
A.生理盐水是依据人体血液的特点配制的
B.表中三种溶液的含盐质量分数均为0.9%纯属巧合
C.人类祖先可能是从原始海洋逐渐进化到陆地上的
D.人体血液与原始海水之间可能有某些尚未认识的关系
二、多项选择题:(每小题2分,共20分,每小题只有1.2个选项符合题意)
11.塑料的使用方便了人类的生活,但由此也带来了“白色污染”。下列解决“白色污染”的合理措施是 ( )
A.焚烧废旧塑料袋
B.废弃塑料回收再利用
C.禁止使用塑料制品
D.使用可降解塑料
12.某同学为了确定Fe,Cu、Hg三种金属的活动性顺序,用铁片、铜片、硝酸汞溶液和盐酸四种试剂设计了下列实验方案,其中可行的是 ( )
A.Fe+HCl Cu+HCI Fe+Hg(N03)2
B.Fe+HCI Fe+Hg(N03)2 Cu+Hg(N03)2
C.Fe+HCl Cu+HCl Cu+Hg(N03)2
D.Cu+HCI Fe+Hg(N03)2 Cu+Hg(N03)2
13.下列说法中,不正确的是 ( )
A.人体中重要的供能营养素有:蛋白质、油脂、微量元素
B.日常生活中用得较多的合成材料有:合成塑料、合成纤维、合成橡胶
C.农业生产中主要的化学肥料有:氮肥、磷肥、钾肥
D.工业上去除油污的方法有:汽油擦洗、洗涤剂清洗、烧碱溶液洗涤
14.为了探究铁和硫酸铜溶液反应中量的关系,某兴趣小组做了五组实验,实验结果记录如下:
编号
加入铁的质量/g
硫酸铜溶液体/mL
生成铜的质量/g
l
1.12
10.0
1.28
2
X
10.O
2.56
3
3.36
10.O
3.84
4
4.48
10.0
4.98
5
5.60
20.O
y
y
则表格中记录的x和Y的数值应分别为 ( )
A.2.24,4.98 B.2.24,6.40
C.3.36,5.12 D.3.36,4.98
15.人类利用金属的历史经历了从青铜器时代到铁器时代,再到铝合金大量使用的过程,这一事实与下列因素有关的是 ( )
A.地壳中金属元素的含量
B.金属的导电性、延展性
C.金属的活动性
D.金属冶炼的水平
16.下列各组溶液,不用其它试剂,就能将组内物质鉴别出来的是 ( )
A.NaCl HCI H2S04 AgN03
B.CuS04 NaOH BaCl2 HCI
C.K2S04 HCl NaOH BaCl2
D.NaOH KOH Mg(N03)2 H2S04
17.50℃时,等质量的两份饱和Ca(OH)2溶液,一份冷却至20℃得溶液甲,另一份加少量CaO后,恢复温度至50℃得溶液乙。则甲、乙两溶液相同的是 ( )
A.Ca(OH)2的溶解度 B.溶液的质量
C.溶质的质量分数 D.溶液中Ca2+数目
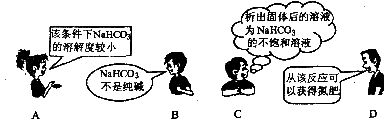
18.“NaCl+C02+NH3+H20=NaHC03↓+NH4Cl”是著名的“侯氏制碱法”的重要反应。下面是4位同学对该反应涉及的有关知识发表的部分见解。其中不正确的是 ( )
19.向CuS04、FeS04的混合溶液中加入锌粉,充分反应后过滤,向过滤所得固体中加入稀H2S04,观察到有无色气体产生,下列对过滤所得固体的有关叙述正确的是 ( )
A.一定有Cu、Zn B.一定有Cu、Fe
C.可能有Zn D.可能有Fe
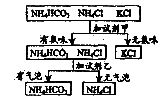
20.下图是某同学鉴别NH4HC03、NH4Cl、KCI三种化肥的过程,其中试剂甲和乙分别可能是 ( )
A.甲:熟石灰; 乙:稀盐酸
B.甲:水; 乙:氢氧化钠溶液
C.甲:氢氧化钠溶液; 乙:稀硫酸
D.甲:稀盐酸; 乙:氯化钠溶液
三、填空题:(共29分)
21.(3分)下表是豆腐中一些成分的平均质量分数:
成 分
水 蛋白质 脂肪
蛋白质
脂肪
糖类
钙
磷
铁
维生素Bl
维生素B2
质量分数/%
90.O
4.7
1.3 1.3
2.8
0.24
0.064
1.4
O.00006
O.00003
除水和无机盐外,豆腐中含有的营养素还有________,含人体所需的微量元素是____。若成年人每天食用80g豆腐,则摄入铁的质量为_____g。
22.(3分)根据图1和图2回答问题:
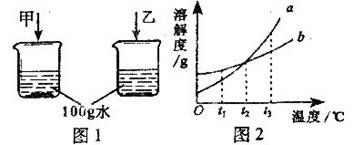
(1)在tl℃时,等质量的甲、乙两种固体物质在水中的溶解现象如图1所示,要使剩余的甲固体继续溶解可采用的方法是___________。
(2)图2中a、b分别表示上述两种物质的溶解度曲线,在_____℃时,这两种物质的溶解度相等;a表示的是____物质(填“甲”或“乙”)的溶解度曲线。
23.(5分)我国自主研发设计的海水法脱硫工艺,已成功应用于大、中型火电机组。其工艺大致流程是:从高而下的海水洗脱从下而上燃煤烟气中的S02,然后与氧气充分接触,再采取跟大量天然海水(pH为8.1~8.3)混合等措施,使各项指标接近天然海水后再排放。
某海滨发电厂(6x600MW)的海水脱硫法与其它脱硫法对比项目如下表所示:
对比项目
海水法
氧化镁法
石灰石法
脱硫效率
>90%
80%
>90%
矿石消耗量
无
3万吨/年(氧化镁)
17.5万吨/年(石灰石)
淡水消耗量
无
150万吨/年
数百万吨/年
脱硫电价成本
¥0.6分/度电
¥1.3分/度电
>¥1.5分/度电
(1)根据上述内容,归纳海水法脱硫的优势和局限。
优势是_____、_____;局限是:________________________________________。
(2)已知洗过烟气后的海水与氧气反应的产物是硫酸钠和盐酸:试写出该反应的化学方程式:___________________________________。
24.(8分)在研讨酸、碱、盐相互间反应关系时,甲、乙两组同学利用碳酸钠溶液按照以下步骤完成实验(假设每步反应都完全)。
第一步:向碳酸钠溶液中加试剂x,过滤,得白色沉淀;
第二步:向该沉淀中加试剂Y,沉淀全部溶解,生成气体,得无色溶液;
第三步:向该溶液中加试剂z,过滤,最终得不溶于酸的白色沉淀和硝酸镁溶液。
(1)甲、乙两组同学共进行三次实验,其中所选的试剂均不相同,乙组同学最终得到的不溶于酸的白色沉淀不同于甲组。请将化学式填入下表:
试剂X
试剂Y
试剂Z
最终得到的白色沉淀
甲组
①
MgCl2
AgCl
乙组
②
HNO3
③
(2)请写出乙组两次实验中碳酸钠溶液与试剂x反应的化学方程式:
____________________、________________________________________。
25.(6分)在锌和氧化铜混合粉末中,加入一定量的稀硫酸充分反应后过滤,发现滤纸上有锌和铜,则滤液所含的溶质是________________(填化学式)。该事实说明锌的金属活动性比铜_______(填“强”或“弱”)。请写出此过程中属于置换反应的化学方程式__________。
26.(4分)材料科学已成为当今世界上最热门的前沿学科之一。材料一般分为金属材料、无机非金属材料、合成材料和复合材料等。2005年3月28日,连续空缺6年的国家技术发明一等奖被授予中国工程院院士、中南大学校长黄伯云所领导的课组,因为他们发明了“高性能炭/炭航空制动材料的制备技术”。黄伯云是益阳南县人,他和他的创新团队历经20年、7000多个日日夜夜的拼搏,在经过无数失败之后,终于获得成功,不仅打破了欧美的垄断和技术封锁、而且性能更优。
(1)“炭/炭航空制动材料”中的两个“炭”字代表两种不同的含碳材料,由此制得的这种航空制动材料属于_______________材料。
(2)合成材料的大量使用有优点也有缺点,请你任意写出其中的优、缺点各一种:优点_______,缺点______________。
(3)从黄伯云的事迹中,对于科学探究,你有什么感想?
四、实验题:(共15分)
27.(4分)“绿色化学”强调实验设计应采取有效措施,节约能源、防止对环境的破坏和污染。
(1)下图A是小欣同学设计的一氧化碳还原氧化铁的实验。该实验符合“绿色化学”要求,体现在:为了防止污染,通过燃烧除去末反应完的,并充分利用其燃烧产生热量,节约能源;
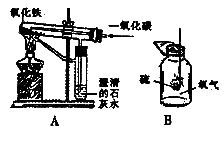
(2)写出上图B中发生反应的化学方程式_______________________________________,该实验不符合“绿色化学”要求,这是因为反应产物会逸散而污染空气,请你就此实验设计一个消除或减少污染的方法________________。
28.(11分)维生素C又名抗坏血酸,易溶于水,易被氧化,能与碘反应。人体缺乏维生素C可能引发多种疾病。某研究性学习小组对它研究如下:
(1)猜想:维生素C可能具有酸性?
(2)实验方案:
提供试剂:维生素C片、蒸馏水、紫色石蕊试液、无色酚酞试液、氢氧化钠溶液pH试纸。(实验仪器自选)
根据以上试剂,请你帮助他们设计出两种实验方案,并写出实验现象:
实验内容
实验现象
方案I:
方案Ⅱ:
(3)结论:维生素C具有酸性。根据维生素C的性质,判断下列物质中能与维生素C反应的是 ( )
A.金属镁 B.氯化钾 C.氢氧化钠 D.硫酸铜
(4)某同学联想到西红柿等蔬菜、水果中含有丰富的维生素C,放置时间长短是否对维生素C的含量产生影响?他设计了如下实验方案:
I 把新鲜西红柿和放置一周的西红柿分别捣碎,用纱布将汁液挤入两个杯中;
Ⅱ 取两支盛有2mL蓝色碘的淀粉溶液的试管,分别滴加上述两种汁液,边加边振荡,直到蓝色刚好消失,记录滴数如下:
汁液
新鲜西红柿的汁液
放置一周的西红柿的汁液
滴数
12
20
请回答下列问题:
①你认为西红柿中维生素C含量高的是_________________________________
②你从中得到的启示是______________________________________________
五、计算题:(共16分)
29.(7分)糖类(按C6H1206、计)在发酵时反应生成乙醇和二氧化碳,其化学反应方程式为:C6H1206=2C2H5OH+2C02↑,生活中1°的酒是指:1体积乙醇和99体积水的混合溶液,问:
(1)多少质量分数的糖类溶液发酵能得10的酒?(水和乙醇的密度分别为1.0g/cm3和O.8g/cm3)(结果保留一位小数)
(2)酿酒厂生产白酒时,常加入适量的一种稀酸溶液来控制酸度,发酵完成后进行蒸馏,即可得到白酒。根据所学化学知识,你认为应加入何种稀酸溶液来控制酸度?为什么?
30.(9分)某钙片的标签如下图,且知此钙片成分中只有碳酸钙含有钙元素:
(1)请通过计算说明此标签中的含钙量是错误的。

(2)为测定其真实的含钙量,小东每次取10片钙片放入已称量的含足量盐酸的烧杯中,发生的化学反应是:CaCO3+2HCI=CaCl2+H20+C02↑,充分反应后再称取烧杯和剩余物的总质量,小东做了三次实验,数据如下:
物质的质量
第1次
第2次
第3次
平均值
反应前:烧杯+盐酸
22g
22g
22g
22g
10片钙片
8g
8g
8g
8g
反应后:烧杯+剩余物
26.7g
26.5g
26.9g
26.7g
① 请列式计算每片此钙片含碳酸钙的质量。
② 请列式计算每片此钙片的含钙量,并建议厂家如何修改标签。