襄樊市优质高中2009届高三联考试题
化 学
命题人:老河口一中 安合林 李 军 审题人:襄阳二中 张 文
考试时间:2009年1月19日 上午8:00―9:30 试卷满分:100分
注意事项:
1.答卷前,考生务必将姓名、准考证号等在答题卡和答题卷上填写清楚。
2.选择题答案用2B铅笔直接填涂在答题卡上,非选择题用0.5mm的黑色签字笔在每题对应的答题区域内做答,答在试题卷上无效。
可能用到的相对原子质量:H=1 N=14 C=12 O=16 S=32 Na=23 Al=27 Cu=64
第Ⅰ卷(选择题,共45分)
一、选择题(每小题只有一个选项符合题意,每小题3分,共45分)
1.化学与科技、生活、社会密切相关。下列说法正确的是
A.20
B.2008年10月以后,北京小汽车仍将按车牌号限时行弛,提倡公民坐公交车,这体现了世界能源危机,符合节约型社会的需要
C.20
D.三聚氰胺(C3N6H6)俗称“伪蛋白”、“蛋白精”,加入到奶粉中,目的是提高含氮量,即提高蛋白质的含量,口感舒适,便于饮用
2.2008年9月25日21时10分,我国“神舟七号”飞船顺利升空,9月27日16时41分,翟志刚成功进行了太空行走。飞船的太阳能电池板有“飞船血液”之称,我国在砷化镓太阳能电池研究方面国际领先。下列有关说法不正确的是
A.砷元素符号为As,位于元素周期表中第四周期第ⅤA族
B.砷化镓的化学式为GaAs3 C.酸性:砷酸<磷酸
D.碱性:Ga(OH)3>Al(OH)3
3.正确掌握化学用语是学好化学的基础,下列有关表述正确的是
A.次氯酸的电子式: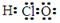 B.质量数为16的氧原子:
B.质量数为16的氧原子: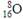
C.F―的结构示意图: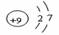
D.碳酸氢根离子的电离方程式: HCO3- + H2O
 H3O++ CO32-
H3O++ CO32-
4.下列说法正确的是
A.电解质溶液导电属于物理变化 B.由一种元素组成的物质一定是纯净物
C.金属氧化物不一定是碱性氧化物 D.水的净化、消毒都属于氧化还原反应
5.用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.2molFeC13制成氢氧化铁胶体,所得胶体的胶粒数为2NA
B.常温下,pH=2的醋酸溶液中所含有的H+数为0.01NA
C.标准状况下,
D.标准状况下,
6.下列能达到实验目的的是
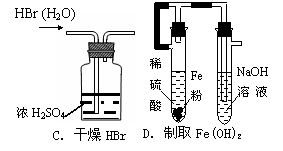 |
|||
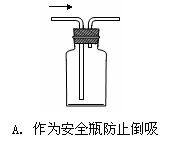 |
|||
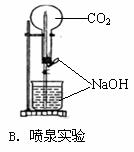
7.下列离子方程式书写正确的是
A.NaHSO4溶液中滴入Ba(OH)2溶液至中性: H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.将少量的硝酸银溶液滴入氨水中 Ag+ + NH3?H2O =AgOH↓ + NH4+
C.硫酸亚铁酸性溶液中加入过氧化氢:4Fe2+ + 2H2O2 + 4H+ =4Fe3+ + 4H2O
D.Ca(HCO3)2溶液中加入过量KOH溶液:Ca2+ + HCO3-+ OH-=CaCO3↓+ H2O
8.在给定条件下,下列加点的物质在化学反应中完全消耗的是
A.标准状况下,将
B.常温下,向100mL3mol/L的硝酸中加入
C.在适当温度和催化剂作用下,用2molSO2和1molO2合成SO3
D.将含有少量H2O(g)的H2通入盛有足量Na2O2容器中并不断用电火花点燃
9.A、B、C、D为四种短周期主族元素,且原子序数依次增大。已知A的最外层电子数是其电子层数的2倍,B是地壳中含量最高的元素,B原子的最外层电子数是D原子最外层电子数的2倍,C原子最外层只有一个电子。下列说法正确的是
A.原子半径: A>C B.离子半径:D>B
C.B和D形成的化合物只能与强酸反应而不能与强碱溶液反应
D.B和C形成的化合物中阴、阳离子的数目比一定为1:2
10.下列有关化学键和晶体结构的说法中正确的是
①晶体中分子间作用力越大,分子越稳定;②原子晶体中共价键越强,熔点越高;③冰融化时水分子中共价键发生断裂;④氯化钠熔化时离子键未被破坏;⑤在晶体中只要有阴离子就一定有阳离子;⑥在晶体中只要有阳离子就一定有阴离子;⑦原子晶体的熔点一定比金属晶体的高;⑧分子晶体的熔点一定比金属晶体的低
A.①②③④ B.⑤⑥⑦⑧ C.②⑤ D.①④⑧
11.下列说法或表示法正确的是
A.需要加热的反应说明它是吸热反应
B.氢气与氧气反应生成等量的水蒸气和液态水,前者放出热量多
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(1);△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ
D.1molS完全燃烧放热297.3kJ,其热化学方程式为:S+O2=SO2,△H=-297.3kJ/mol
12.有M、N两溶液,各含下列14种离子中的7种:Al3+、Cl-、Na+、K+、NO3-、OH-、S2-、MnO4-、Fe3+、AlO2-、CO32-、NH4+、SO42-、H+。已知两溶液所含离子各不相同,M溶液里的阳离子只有两种,则N溶液里的阴离子应该是
A.OH-、S2-、CO32- B.MnO4-、SO42-、NO3-
C.Cl-、NO3-、SO42- D.AlO2-、MnO4-、SO42-
13.室温下,甲、乙两烧杯中分别盛有体积为V1LpH=3的醋酸和体积为V2LpH=4的醋酸,现向两烧杯中均加入足量的锌粉,充分反应后,测得在相同条件下两烧杯中产生氢气的体积相等。则下列说法中正确的是
A.反应开始时两容器中的反应速率相等 B.两容器中醋酸的物质的量相等
C.加入锌粉前两烧杯中醋酸根离子浓度关系为:甲<乙
D.醋酸溶液的体积关系是10V1 = V2
14.有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯化铝锂(LiAlCl4)溶解在亚硫酰氯(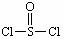 )中形成的,其电池总反应方程式为:
)中形成的,其电池总反应方程式为:
8Li+3SOCl2=6LiCl+Li2SO3+2S。下列叙述中正确的是
A.电池工作过程中,亚硫酰氯(SOCl2)被部分还原成S
B.电池工作过程中,金属锂提供的电子与负极区析出的硫的物质的量之比为4:1
C.电解质溶液可以用水,也可以用饱和食盐水
D.锂电池充电时,金属锂接电源的正极,石墨接电源的负极
15.某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g) 
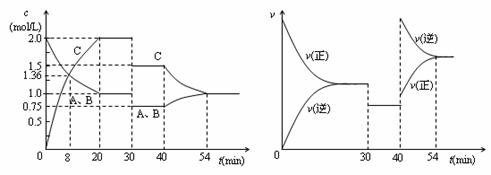
A.30min时降低温度,40min时升高温度
B.8min前A的平均反应速率为0.64mol/(L?min)
C.反应方程式中的x=1,正反应为吸热反应
D.20~30min时A、B的转化率均为50%
第Ⅱ卷(非选择题,共55分)
二、本大题包括2小题,共18分
16.(8分)2008年5月12日四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒剂、漂白剂等。
(1)二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与SO2反应制得。请写出反应的离子方程式 。
(2)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3?3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是 。(填序号)
A.稀盐酸 B.Na2SO3溶液 C.MnO2 D.KMnO4溶液
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2 → ClO2↑+ H+ +Cl-+H2O(未配平)。当amolHClO2发生分解反应时,转移的电子数是 个。
(4)有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,则该反应中氧化产物与还原产物的物质的量之比为 。
17.(10分)某学校研究性学习小组设计实验探究铝等金属的性质:将一置于空气中的铝片投入浓氯化铜溶液中,铝片表面出现一层海绵状暗红色物质,接下来铝片上产生大量气泡,产生的气体具有可燃性,溶液温度迅速上升。若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化。
⑴铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因
可能是___________。(填序号)
A.铝与Cl―反应,铝与SO42―不反应
B.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
C.硫酸铜水解生成硫酸使铝钝化
D.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
E.生成氯化铝溶于水,而生成硫酸铝不溶于水
⑵铝片表面出现的暗红色物质是 ;放出的气体是________。
⑶请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的原因是 。
⑷某同学通过其它的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是_____________________。(填序号)
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.向硫酸铜溶液中加入氯化钠固体,再投入铝片
⑸除去氧化铝的铝片与镁片为电极,在X电解质溶液中构成原电池,列表如下:
选项
铝电极
电解质
负极反应
正极反应
A
负极
NaOH
2Al―6e―+8OH―=2AlO2―+4H2O
6H2O+6e―=6OH―+3H2↑
B
负极
稀盐酸
2Al―6e―=2Al3+
6H++6e―=3H2↑
C
正极
浓硝酸
Mg+2e―=Mg2+
2NO3―+4H+―4e―=2NO2↑+2H2O
其中正确的是 (填序号),由此推知,金属作电极不仅与本身性质相关,而且与 有关。
三、本大题包括2小题,共18分
18.(10分)元素周期表是学习物质结构和性质的重要工具,下面是元素周期表的一部分,表中所列字母A、D、E、G、Q、M、R、T分别代表某一化学元素。请用所给元素回答下列问题。
A
D
E
G
Q
M
R
T
⑴某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为 。
 ⑵M、R两种元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由小到大的顺序是
(填离子符号)。
⑵M、R两种元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由小到大的顺序是
(填离子符号)。
⑶M、D两种元素形成的化合物含有的化学键类型是 ,其分子属于(填“极性”或“非极性”) 分子;A分别与D、E、R形成的分子中,分子间存在氢键的是(填分子式) ;A与D形成分子的空间结构可能是(填下列球棍模型序号) 。
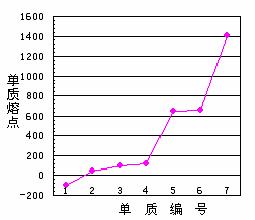

a b c d
⑷从所给元素中组成合适的反应物,用化学方程式表明元素M、R的非金属性强弱
。
⑸第三周期主族元素单质熔点高低的顺序如右图所示,“1”所代表物质的化学式是
,“
19.(8分)A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(副产物已略去)。请按要求回答下列问题:
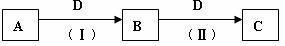
⑴若D为强氧化性单质,则A可能是 (填序号)
a. Na b. Mg c. Al d.S e.NH3
⑵若D为用途最广的金属单质,向C的溶液中滴加AgNO3溶液,产物不溶于稀硝酸的白色沉淀,则B的化学式为 ;C溶液在贮存时应加入少量的D,理由是 ;检验B溶液中金属元素的离子方程式为 。
⑶若D为强电解质,A和C在溶液中反应生成的B是白色絮状沉淀,则B的化学式为 ,A和C反应的离子方程式是 。
四、本大题包括1小题,共11分
20.(11分)某化学兴趣小组采用下列方法测定Na2SO3样品中Na2SO4的质量分数。
【方法一】测 SO2质量法

采用如上图所示装置,通过实验测定生成SO 2的质量。
⑴A装置的名称 ,C中盛放的试剂是 ,E装置的作用是 。
⑵若实验前称取10g样品,测得SO2的质量为0.64g,则样品中Na2SO4质量分数为 ,该方法的缺点是 。(只答一点即可)
【方法二】加热转化法
称取ag样品,置于硬质玻璃管中通入氧气加热一段时间,Na2SO3被氧化为Na2SO4 ,则可能发生的化学反应方程式为 ;若冷却后称得固体质量为bg,则样品中Na2SO4质量分数为 ,该方法的缺点是 。(只答一点即可)
【方法三】测沉淀质量法
第一步:称取样品质量,置于小烧杯中;
第二步:向小烧杯中加入足量稀盐酸,加热;
第三步:向小烧杯中加入足量BaCl2溶液,然后过滤、洗涤;
第四步:干燥沉淀,并称取沉淀质量。
⑴方案中BaCl2能否改成Ba(NO3)2? (填“能”或“不能”);试简述原因 。
⑵简述洗涤沉淀的方法: 。
五、本大题包括1小题,共8分
21.(8分)铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l 、+2。已知Cu2O与稀硫酸反应的化学方程式为:Cu2O+H2SO4=Cu+CuSO4+H2O。现向Cu、Cu2O和CuO组成的混合物中,加入2L0.6mol/L HNO3溶液恰好使混合物溶解,同时收集到4480mLNO气体(标准状况)。请回答下列问题:
⑴写出Cu2O跟稀硝酸反应的离子方程式 。
⑵若将上述混合物用足量的H2加热还原,所得到固体的质量为 。
⑶若混合物中含0.15molCu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 。
⑷若混合物中Cu的物质的量为nmol,则n的取值范围为 。


 襄樊优质高中2009届高三联考
襄樊优质高中2009届高三联考


 化学试卷答题卡
化学试卷答题卡



1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A
B
D
C
C
B
C
D
D
C
C
B
B
A
D
16.每空2分,共8分。
(1)2ClO3-+SO2 ===2ClO2+SO42-;(2)D;(3)4.816a×1023;(4)8┱1。
17.共10分。
⑴D(1分);⑵Cu(1分);H2(1分);⑶①随着反应进行生成铝离子浓度增大,水解产生的H+的浓度增大,②该反应放热,升高温度反应加快,③铜与铝构成原电池,加快铝溶解;(3分)⑷A、B、D;(2分,少选、错选均不给分)⑸A(1分),电解质性质(1分)(其它合理解答同样给分)。
 18.共10分。
18.共10分。
⑴Na (1分) ;⑵ Cl―<S2―(1分)
⑶极性共价键(1分),非极性分子(1分);NH3(1分);c、d (1分,少选、错选均不给分) ;⑷H2S+Cl2=2HCl+S↓(2分);⑸Cl2(1分), 原子晶体(1分)。
19.每个方程式2分,其它每空1分,共8分。
⑴ade(1分,少选、错选均不给分);⑵FeCl3(1分);防止氯化亚铁被氧化(1分);Fe3++3SCN-=Fe(SCN)3(2分,合理反应都可以给分);⑶Al(OH)3(1分);Al3++3AlO2-+6H2O=4Al(OH)3↓(2分)。
20.每空1分,共11分。
【方法一】⑴分液漏斗;浓硫酸;防止外界水蒸气进入;⑵87.4% ;SO2不能完全被吸收 ,装置中有SO2滞留。
【方法二】2Na2SO3+O2=2Na2SO4
;[(
【方法三】(1)不能;酸性条件下Ba(NO3)2将SO2氧化成BaSO4;(2) 向漏斗内加水至刚好浸没沉淀,待水自然流出后再加水洗涤2~3次。
21.每空2分,共8分。
⑴3Cu2O+14H+ +2NO3- =6Cu2+ +2NO↑+7H2O;⑵32g;⑶0.2mol;⑷0.1<n<0.3。