网址:http://m.1010jiajiao.com/timu_id_548793[举报]
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A
B
D
C
C
B
C
D
D
C
C
B
B
A
D
16.每空2分,共8分。
(1)2ClO3-+SO2 ===2ClO2+SO42-;(2)D;(3)4.816a×1023;(4)8┱1。
17.共10分。
⑴D(1分);⑵Cu(1分);H2(1分);⑶①随着反应进行生成铝离子浓度增大,水解产生的H+的浓度增大,②该反应放热,升高温度反应加快,③铜与铝构成原电池,加快铝溶解;(3分)⑷A、B、D;(2分,少选、错选均不给分)⑸A(1分),电解质性质(1分)(其它合理解答同样给分)。
 18.共10分。
18.共10分。
⑴Na (1分) ;⑵ Cl―<S2―(1分)
⑶极性共价键(1分),非极性分子(1分);NH3(1分);c、d (1分,少选、错选均不给分) ;⑷H2S+Cl2=2HCl+S↓(2分);⑸Cl2(1分), 原子晶体(1分)。
19.每个方程式2分,其它每空1分,共8分。
⑴ade(1分,少选、错选均不给分);⑵FeCl3(1分);防止氯化亚铁被氧化(1分);Fe3++3SCN-=Fe(SCN)3(2分,合理反应都可以给分);⑶Al(OH)3(1分);Al3++3AlO2-+6H2O=4Al(OH)3↓(2分)。
20.每空1分,共11分。
【方法一】⑴分液漏斗;浓硫酸;防止外界水蒸气进入;⑵87.4% ;SO2不能完全被吸收 ,装置中有SO2滞留。
【方法二】2Na2SO3+O2=2Na2SO4
;[(
【方法三】(1)不能;酸性条件下Ba(NO3)2将SO2氧化成BaSO4;(2) 向漏斗内加水至刚好浸没沉淀,待水自然流出后再加水洗涤2~3次。
21.每空2分,共8分。
⑴3Cu2O+14H+ +2NO3- =6Cu2+ +2NO↑+7H2O;⑵32g;⑶0.2mol;⑷0.1<n<0.3。
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.以下是过氧化氢法生产亚氯酸钠的部分工艺流程图:

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O.
②160 g/LNaOH溶液是指160 gNaOH固体溶于水所得溶液的体积为1 L.
(1)吸收塔内的反应的化学方程式为
2NaOH+2ClO2+H2O2![]() 2NaClO2+2________+________,
2NaClO2+2________+________,
若1 mol ClO2参加反应,则转移电子的物质的量是________mol;
(2)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是________(选填序号),
a.蒸馏
b.蒸发
c.灼烧
d.过滤
e.冷却结晶
要得到更纯的NaClO2·3H2O晶体必须进行的操作是________(填操作名称);
(3)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是________;
(4)160 g/L NaOH溶液的物质的量浓度为________,若要计算该溶液的质量分数,还需要的一个条件是________(用文字说明).
(2)一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH-4e-+H2O═CH3COOH+4H+,检测有酒精时,电解质溶液中的H+向
(3)X、Y、Z、M、G五种分属三个短周期主族元素,且原子序数依次增大.Z存在质量数为23,中子数为12的核素A;Y、M同主族,可形成MY2、MY3两种分子.
回答下列问题:
ⅰ、用化学符号表示核素A:
ⅱ、上述元素的最高价氧化物对应的水化物酸性最强的是
ⅲ、X2M的电子式为


ⅳ、ZG用途广泛,下列说法正确的是:
A、作调味剂 B、用于食物防腐 C、用于氯碱工业 D、用于医疗.
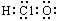 B.质量数为137的钡原子:
B.质量数为137的钡原子: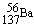
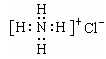 D. Cl离子的结构示意图:
D. Cl离子的结构示意图: 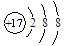
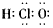
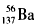
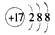
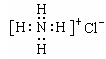 D. Cl离子的结构示意图:
D. Cl离子的结构示意图: