网址:http://m.1010jiajiao.com/timu_id_548821[举报]
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A
B
D
C
C
B
C
D
D
C
C
B
B
A
D
16.每空2分,共8分。
(1)2ClO3-+SO2 ===2ClO2+SO42-;(2)D;(3)4.816a×1023;(4)8┱1。
17.共10分。
⑴D(1分);⑵Cu(1分);H2(1分);⑶①随着反应进行生成铝离子浓度增大,水解产生的H+的浓度增大,②该反应放热,升高温度反应加快,③铜与铝构成原电池,加快铝溶解;(3分)⑷A、B、D;(2分,少选、错选均不给分)⑸A(1分),电解质性质(1分)(其它合理解答同样给分)。
 18.共10分。
18.共10分。
⑴Na (1分) ;⑵ Cl―<S2―(1分)
⑶极性共价键(1分),非极性分子(1分);NH3(1分);c、d (1分,少选、错选均不给分) ;⑷H2S+Cl2=2HCl+S↓(2分);⑸Cl2(1分), 原子晶体(1分)。
19.每个方程式2分,其它每空1分,共8分。
⑴ade(1分,少选、错选均不给分);⑵FeCl3(1分);防止氯化亚铁被氧化(1分);Fe3++3SCN-=Fe(SCN)3(2分,合理反应都可以给分);⑶Al(OH)3(1分);Al3++3AlO2-+6H2O=4Al(OH)3↓(2分)。
20.每空1分,共11分。
【方法一】⑴分液漏斗;浓硫酸;防止外界水蒸气进入;⑵87.4% ;SO2不能完全被吸收 ,装置中有SO2滞留。
【方法二】2Na2SO3+O2=2Na2SO4
;[(
【方法三】(1)不能;酸性条件下Ba(NO3)2将SO2氧化成BaSO4;(2) 向漏斗内加水至刚好浸没沉淀,待水自然流出后再加水洗涤2~3次。
21.每空2分,共8分。
⑴3Cu2O+14H+ +2NO3- =6Cu2+ +2NO↑+7H2O;⑵32g;⑶0.2mol;⑷0.1<n<0.3。
元素周期表是学习物质结构和性质的重要工具,下面是元素周期表的一部分,表中所列字母A、D、E、G、Q、M、R、T分别代表某一化学元素。请用所给元素回答下列问题。
| A | |||||||||||||||||
| D | E | ||||||||||||||||
| G | Q | M | R | ||||||||||||||
| T | |||||||||||||||||
(1)某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为 。
![]() (2)某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号) 。
(2)某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号) 。
(3)M、D两种元素形成的化合物含有的化学键类型是 ,其分子是(填“极性”或“非极性”) 分子;A分别与D、E、R形成的分子中,分子间存在氢键的是(填分子式) 。A与D形成分子的空间结构可能是(填序号) 。
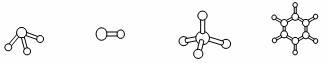
a b c d
图1
(4)从所给元素中组成合适的反应物,用化学方程式表明元素M、R的非金属性强弱:
。
(5)第三周期主族元素单质熔点高低的顺序如图2所示,“1”所代表物质的化学式是 ,“7”所对应的元素形成最高价氧化物的晶体类型是 。

图2
查看习题详情和答案>>