高考热点专题测试卷:专题四 离子反应及离子共存
说明:本试卷共分两卷,第Ⅰ卷为选择题,把正确答案序号填在题后答题卡内.第Ⅱ卷为非选择题,直接在本卷内作答.
第Ⅰ卷(共83分)
一、选择题:每小题3分,5小题共15分.每小题只有一个选项正确.把正确选项的代号填在题后答题卡中.
1.下列反应的离子方程式不正确的是( )
A.向烧碱溶液中滴加少量氯化铝溶液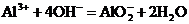
B.物质的量相等的溴化亚铁跟氯气反应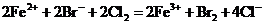
C.硫化钾晶体溶于水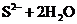

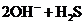
D.向碳酸钠溶液中滴加过量的稀硫酸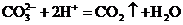
2.某无色透明的溶液,在pH=0和pH=14的条件下都能大量共存的是( )
A.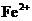
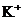
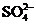
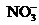 B.
B.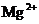
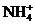
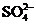
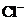
C.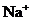
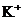
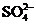
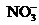 D.
D.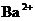
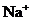
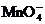
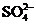
3.下列离子方程式书写正确的是( )
A.碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液
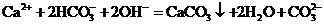
B.碳酸钠溶液中加入等物质的量的乙酸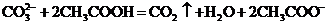
C. 溶液中通入过量的二氧化硫气体
溶液中通入过量的二氧化硫气体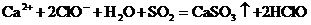
D.用碳棒作电极电解氯化钠饱和溶液 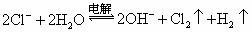
4.下列离子反应方程式正确的是( )
A.小苏打溶液中加入过量石灰水 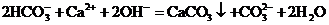
B.氯化铝溶液中加入过量氨水 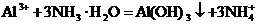
C.氯化亚铁溶液中通入氯气 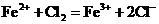
D.苛性钾溶液中加入稀醋酸 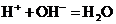
5.下列反应的离子方程式书写正确的是( )
A.金属钠跟水反应: 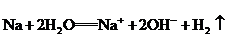
B.向偏铝酸钠溶液中加入少量硫酸氢钠溶液 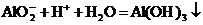
C.澄清石灰水中滴入少量的NaHCO3溶液 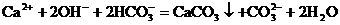
D.浓盐酸跟二氧化锰混合共热 
二、选择题:本题包括8小题,每小题4分,共32分.每小题有一个或二个选项符合题意.若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该题就为0分.把正确选项的代号填在题后答题卡中.
6.下列各组离子,在所给条件下能够大量共存的是( )
A.pH=0的溶液中,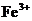 、
、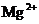 、
、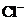 、
、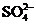
B.水电离出的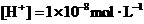 的溶液中,
的溶液中,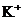 、
、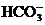 、
、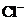 、
、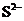
C.使pH试纸显深蓝色的溶液中, 、
、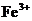 、
、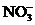 、
、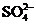
D.在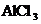 溶液中
溶液中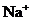 、
、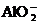 、
、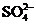 、
、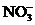
7.下列离子方程式的书写正确的是( )
A.过量二氧化碳通入偏铝酸钠溶液中: 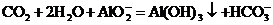
B.在溶液中亚硫酸氢铵与等物质的量氢氧化钠混合
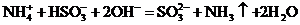
C.氯气通入冷的烧碱溶液中: 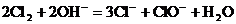
D.硫酸氢钠溶液中加入碳酸氢钠溶液: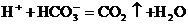
8.某溶液中由水电离出的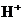 浓度为
浓度为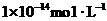 ,在此溶液中可能大量共存的离子是( )
,在此溶液中可能大量共存的离子是( )
A.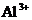 、
、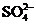 、
、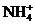 、
、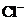 B.
B.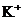 、
、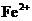 、
、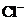 、
、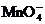
C.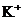 、
、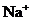 、
、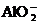 、
、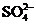 D.
D.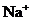 、
、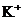 、
、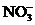 、
、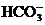
9.下列离子方程式书写正确的是( )
A.在碘化亚铁溶液中通入足量氯气: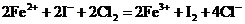
B.用铂电极电解氯化钠饱和溶液: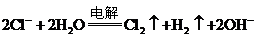
C.向硫酸亚铁溶液中通入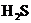 气体:
气体: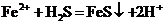
D.氯化铵溶于水: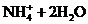

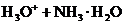
10.下列反应的离子方程式正确的是( )
A.硫酸亚铁酸性溶液中加入过氧化氢 
B.氯化铝溶液通入过量氨水 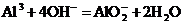
C.碳酸钙溶于醋酸 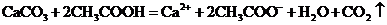
D.次氯酸钙溶液中通入过量二氧化碳 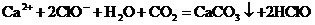
11.下列各组离子能大量共存于同一溶液中,且加入过量NaOH溶液或少量稀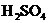 时,都能产生白色沉淀的是( )
时,都能产生白色沉淀的是( )
A.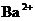 、
、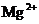 、
、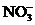 、
、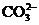 B.
B.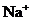 、
、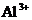 、
、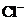 、
、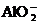
C.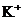 、
、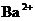 、
、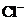 、
、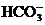 D.
D.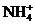 、
、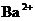 、
、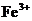 、
、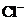
12.向等物质的量浓度的NaA和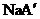 溶液中分别通入适量的
溶液中分别通入适量的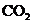 ,发生如下反应:
,发生如下反应: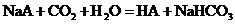
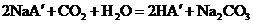 现有等物质的量浓度的NaA、
现有等物质的量浓度的NaA、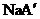 、
、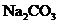 、
、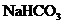 四种溶液,其溶液pH的关系正确的是( )
四种溶液,其溶液pH的关系正确的是( )
A.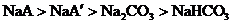 B.
B.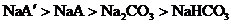
C.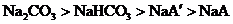 D.
D.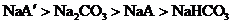
13.下列离子方程式写正确的是( )
A.过量二氧化碳通入偏铝酸钠溶液中 
B.用湿润的醋酸铅试纸检验硫化氢气 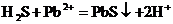
C.氯化铵溶于水 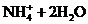

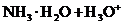
D.用烧碱溶液吸收尾气中少量二氧化硫 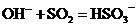
三、选择题:每小题4分,9小题共36分.每小题只有一个选项正确
14.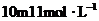 的
的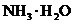 与
与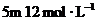 的盐酸恰好完全中和,最后溶液中所含离子的浓度大小顺序是( )
的盐酸恰好完全中和,最后溶液中所含离子的浓度大小顺序是( )
A.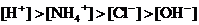 B.
B.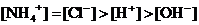
C.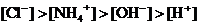 D.
D.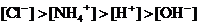
15.下列离子方程式正确的是( )
A.漂白粉溶于盐酸: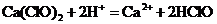
B.磷酸二钠溶液中加入足量的氢氧化钡溶液
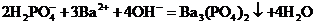
C.铝溶于氢氧化钠溶液中: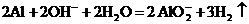
D.饱和氯化铁溶液滴加沸水中: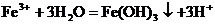
16.某二元弱酸的酸式盐NaHA溶液,若pH>7时,测混合液中各离子的浓度大小关系不正确的是( )
A.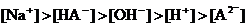 B.
B.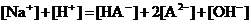
C.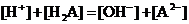 D.
D.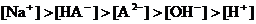
17.在指定的条件下,下列各组离子能大量共存的是( )
A.强碱性溶液中: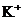 、
、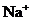 、
、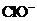 、
、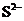
B.pH=1的溶液中: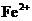 、
、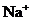 、
、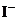 、
、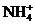
C.与Al反应产生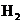 的溶液中:
的溶液中: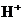 、
、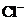 、
、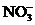 、
、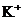
D.由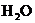 电离出的
电离出的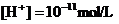 溶液中:
溶液中: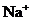 、
、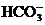 、
、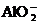 、
、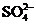
18.下列离子方程式书写正确的是( )
A.向 溶液中滴加
溶液中滴加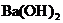 溶液显中性
溶液显中性 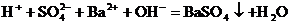
B.向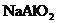 溶液中加盐酸至呈酸性
溶液中加盐酸至呈酸性 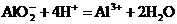
C.碳酸氢铵溶液中加入过量 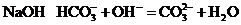
D.向苯酚钠溶液中通入过量
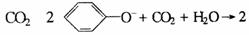
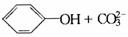
19.下列离子方程式正确的是( )
A.NaHS水解反应: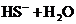

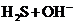
B.石灰石溶于醋酸: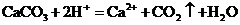
C.Al投入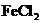 溶液中:
溶液中: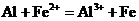
D.往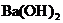 溶液中滴入
溶液中滴入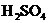 溶液:
溶液: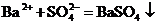
20.下列各组离子中能在水溶液中大量共存,且溶液显酸性的是( )
A.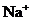 、
、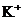 、
、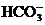 、
、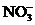 B.
B.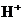 、
、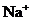 、
、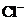 、
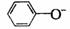
、
C.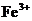 、
、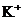 、
、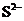 、
、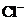 D.
D. 、
、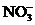 、
、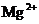 、
、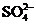
21.下列反应的离子方程式正确的是( )
A.碳酸氢钠溶液跟过量的饱和石灰水反应
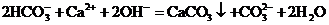
B.向氢氧化钠溶液中加入稀醋酸 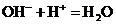
C.向氯化铁溶液中加入铁粉 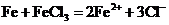
D.向硝酸镁溶液中加过量氨水 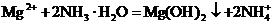
22.下列反应的离子方程式正确的是( )
A.用氨水吸收少量二氧化硫: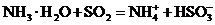
B.碳酸氢钠溶液中加入少量烧碱: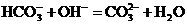
C.碳酸亚铁固体加入稀硝酸: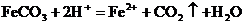
D.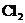 溶解在水中:
溶解在水中: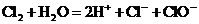
答题卡
题号
1
2
3
4
5
6
7
8
9
10
11
分值
3分
3分
3分
3分
3分
4分
4分
4分
4分
4分
4分
选项
题号
12
13
14
15
16
17
18
19
20
21
22
分值
4分
4分
4分
4分
4分
4分
4分
4分
4分
4分
4分
选项
第Ⅱ卷(共67分)
四、本题包括2小题共15分
23.(7分)(1)硝酸铅的稀溶液中,滴入几滴稀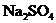 生成白色
生成白色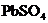 沉淀,再滴入数滴饱和醋酸钠溶液,微热,并不断搅动,沉淀慢慢溶解,以上发生的都是复分解反应,写出反应过程的离子方程式______________,试推测第二步离子反应发生原因是________
______.
沉淀,再滴入数滴饱和醋酸钠溶液,微热,并不断搅动,沉淀慢慢溶解,以上发生的都是复分解反应,写出反应过程的离子方程式______________,试推测第二步离子反应发生原因是________
______.
(2)边微热边向铵明矾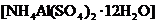 溶液中逐滴加入
溶液中逐滴加入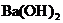 溶液至中性.
溶液至中性.
①此时发生反应的离子方程式为______________.
②向以上所得中性溶液中继续滴加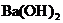 溶液,这一步离子反应的离子方程式是______________.
溶液,这一步离子反应的离子方程式是______________.
24.(8分)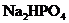 溶液呈弱碱性,
溶液呈弱碱性,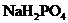 溶液呈弱酸性,在
溶液呈弱酸性,在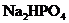 溶液中加入
溶液中加入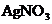 溶液,有黄色沉淀生成,且溶液由弱碱性转变为弱酸性.
溶液,有黄色沉淀生成,且溶液由弱碱性转变为弱酸性.
(1)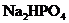 溶液呈弱碱性的原因是_____________;
溶液呈弱碱性的原因是_____________;
(2)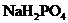 溶液呈弱酸性的原因是_____________;
溶液呈弱酸性的原因是_____________;
(3)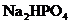 与
与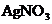 反应生成
反应生成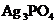 黄色沉淀的离子方程式是____________.
黄色沉淀的离子方程式是____________.
五、本题包括2小题共15分w.w.w.k.s.5.u.c.o.m
25.(8分)现有A、B、C、D、E五种盐溶液,分别由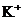 、
、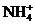 、
、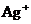 、
、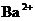 、
、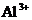 、
、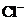 、
、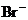 、
、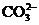 、
、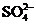 、
、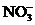 中的阳离子和阴离子各一种组成(五种盐所含阴、阳离子各不相同).已知:①A+B→白↓ ②A+D→白↓ ③B+C→白↓ ④D+C→白↓ ⑤A溶液中
中的阳离子和阴离子各一种组成(五种盐所含阴、阳离子各不相同).已知:①A+B→白↓ ②A+D→白↓ ③B+C→白↓ ④D+C→白↓ ⑤A溶液中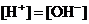 ⑥B溶液中
⑥B溶液中 ⑦C、D、E三种溶液的pH<7,根据以上实验事实可以推出(用分子式表示)A为___________________;B为__________________;C为___________________;D为__________________;E为___________________.
⑦C、D、E三种溶液的pH<7,根据以上实验事实可以推出(用分子式表示)A为___________________;B为__________________;C为___________________;D为__________________;E为___________________.
写出以上各步反应的离子方程式:
①_________________________________________________________________________
②_________________________________________________________________________
③_________________________________________________________________________
④_________________________________________________________________________
26.(7分)在含有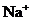 、
、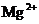 、
、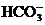 、
、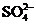 的稀溶液中,各离子的物质的量之比为:
的稀溶液中,各离子的物质的量之比为: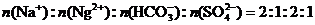
(1)向该溶液中滴加酚酞试液数滴,溶液呈________色.有关反应的离子方程式为:___________________________.
(2)充分加热(1)步所得的溶液,加热的过程中观察到的现象有_________________;完全反应后,溶液呈_________________色,有关反应的离子方程式为:_________________.
六、本题包括2小题共17分w.w.w.k.s.5.u.c.o.m
27.(7分)(1)在酸性介质中,往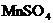 溶液里滴加
溶液里滴加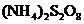 (连二硫酸铵)溶液会发生如下离子反应:
(连二硫酸铵)溶液会发生如下离子反应: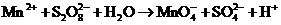
该反应常用于检验 的存在,其特征现象是________________.
的存在,其特征现象是________________.
若反应中有0.1 mol还原剂参加反应,则消耗氧化剂的物质的量为________________mol.
(2)向含有等物质的量浓度的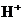 、
、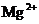 、
、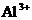 、
、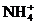 混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应.其中:
混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应.其中:
第二个离子反应方程式为_______________.
最后一个离子反应方程式为________________.
28.(10分)某无色溶液,其中有可能存在的离子如下: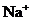 、
、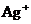 、
、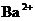 、
、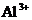 、
、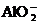 、
、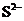 、
、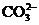 、
、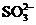 、
、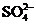 ,现取该溶液进行有关试验,实验结果如下图所示:
,现取该溶液进行有关试验,实验结果如下图所示:

试回答下列问题:
(1)沉淀甲是:___________________________,
(2)沉淀乙是:_________________,由溶液甲生成沉淀乙的离子方程式为:_________________.
(3)沉淀丙是:__________________.
(4)气体甲成分可能有哪几种?(可以不填满也可以补充)
1
2
3
4
5
6
(5)综合上述信息,可以肯定存在的离子:_______________.
七、本题包括2小题共20分
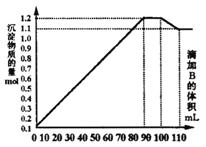
29.(7分)向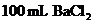 、
、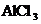 和
和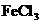 的混合溶液A中,逐滴加入
的混合溶液A中,逐滴加入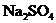 和NaOH的混合溶液B,产生的沉淀和加入溶液B的体积关系如右图所示:
和NaOH的混合溶液B,产生的沉淀和加入溶液B的体积关系如右图所示:
(2)溶液B中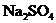 与NaOH的物质的量浓度之比________________;从90 mL至100 mL之间加入10 mL B溶液时所发生的离子反应方程式是________________.
与NaOH的物质的量浓度之比________________;从90 mL至100 mL之间加入10 mL B溶液时所发生的离子反应方程式是________________.
(3)将A、B溶液中各溶质的物质的量浓度填入下表:
溶质
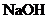
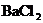
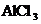
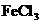
浓度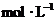
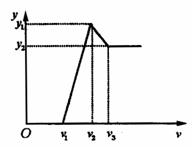
30.(13分)向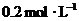 的
的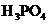 溶液30 mL中逐滴加入
溶液30 mL中逐滴加入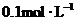 的
的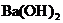 溶液,生成沉淀量y(mol)与加入
溶液,生成沉淀量y(mol)与加入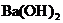 溶液体积V(mL)有如右图像:
溶液体积V(mL)有如右图像:
(1)当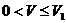 时,反应的离子方程式是________,
时,反应的离子方程式是________,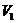 =______________.
=______________.
(2)当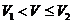 时,反应的离子方程式是________.此过程中沉淀的成分是_________,
时,反应的离子方程式是________.此过程中沉淀的成分是_________,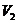 =________,
=________,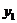 =_________.
=_________.
(3)当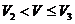 时,溶液中反应的离子方程式是________,沉淀的成分是_________,
时,溶液中反应的离子方程式是________,沉淀的成分是_________,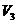 =_________,
=_________,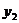 =_________.
=_________.
(4)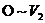 阶段总反应的离子方程式为_________.
阶段总反应的离子方程式为_________.
(5)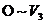 阶段反应的离子方程式为________.
阶段反应的离子方程式为________.
(6)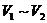 阶段总反应的离子方程式为________.
阶段总反应的离子方程式为________.
w.w.w.k.s.5.u.c.o.m
1.C 2.C 3.D 4.B 5.B 6.A 7.AD 8.AC 9.BD 10.AC 11.C
12.D 13.AC 14.D 15.B 16.D 17.B 18.B 19.A 20.D 21.D 22.B
23.(1) ;
; ;生成了弱电解质
;生成了弱电解质 ,破坏了
,破坏了 的溶解平衡.
的溶解平衡.
(2)①


②
24.(1) 在溶液中存在
在溶液中存在 的电离,
的电离,

 ,同时还存在
,同时还存在 离子的水解,
离子的水解,

 ,
, 溶液呈弱碱性,说明
溶液呈弱碱性,说明 的水解反应占优势.
的水解反应占优势.
(2) 在溶液中存在着
在溶液中存在着 离子的电离,同时又存在
离子的电离,同时又存在 离子的水解,
离子的水解, 呈弱酸性说明
呈弱酸性说明 离子的电离比水解来得强.
离子的电离比水解来得强.
(3)
25.A: B:
B: C:
C: D:
D: E:
E:
① ②
② ③
③
④
26.(1)粉红 


(2)放出气体,溶液变浑浊,红色加深红

27.(1)溶液变成紫红色,0.25 (2) ,
, w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
28.(1)硫 (2) ;
;
(3) ,可能含有
,可能含有 (4)
(4) 、
、 、
、 、
、 和
和 、
、 和
和
(5) 、
、 、
、
29.解析:①溶液中 被完全沉淀出后,
被完全沉淀出后, 才开始沉淀.图中曲线第二段为平行直线,沉淀总物质的量没有增减.故这段是因
才开始沉淀.图中曲线第二段为平行直线,沉淀总物质的量没有增减.故这段是因 的溶解和
的溶解和 的继续生成导致,且溶解的
的继续生成导致,且溶解的 的物质的量和生成的
的物质的量和生成的 物质的量相等.故加入的物质:
物质的量相等.故加入的物质:
 这段的离子方程式为:
这段的离子方程式为:


②第一段生成的沉淀为 、
、 和
和 ,且B为90 mL时,
,且B为90 mL时, 、
、 恰好沉淀完全.这段反应的离子方程式为:
恰好沉淀完全.这段反应的离子方程式为: ,
,
 ,
,
③图中曲线第三段(100-110 mL),B为100 mL时 恰好沉淀完全.这段中
恰好沉淀完全.这段中 继续溶解,B为110 mL时,沉淀中
继续溶解,B为110 mL时,沉淀中 已完全溶解.这段中溶解了
已完全溶解.这段中溶解了 ,消耗了10 mL NaOH,故
,消耗了10 mL NaOH,故 ,则100 mL时,共加入
,则100 mL时,共加入 为0.1 mol,共生成
为0.1 mol,共生成 ,故A溶液中
,故A溶液中 .这段
.这段 溶解的离子方程式为:
溶解的离子方程式为:
④图中曲线第四段中,沉淀为 、
、 共0.11 mol,则
共0.11 mol,则
 为0.11 mol,A中
为0.11 mol,A中 .
.
⑤第二、三段间共消耗 ,则共溶解的
,则共溶解的 为0.02 mol,则A中
为0.02 mol,则A中 .w.w.w.k.s.5.u.c.o.m
.w.w.w.k.s.5.u.c.o.m
30.(1) ;
;
(2) ;
; ;
; ,
,

(3) ;
; ;
; ,
,
(4) ;
;
(5)
(6)
 www.ks5u.com
www.ks5u.com