网址:http://m.1010jiajiao.com/timu_id_499812[举报]
1.C 2.C 3.D 4.B 5.B 6.A 7.AD 8.AC 9.BD 10.AC 11.C
12.D 13.AC 14.D 15.B 16.D 17.B 18.B 19.A 20.D 21.D 22.B
23.(1) ;
; ;生成了弱电解质
;生成了弱电解质 ,破坏了
,破坏了 的溶解平衡.
的溶解平衡.
(2)①


②
24.(1) 在溶液中存在
在溶液中存在 的电离,
的电离,

 ,同时还存在
,同时还存在 离子的水解,
离子的水解,

 ,
, 溶液呈弱碱性,说明
溶液呈弱碱性,说明 的水解反应占优势.
的水解反应占优势.
(2) 在溶液中存在着
在溶液中存在着 离子的电离,同时又存在
离子的电离,同时又存在 离子的水解,
离子的水解, 呈弱酸性说明
呈弱酸性说明 离子的电离比水解来得强.
离子的电离比水解来得强.
(3)
25.A: B:
B: C:
C: D:
D: E:
E:
① ②
② ③
③
④
26.(1)粉红 


(2)放出气体,溶液变浑浊,红色加深红

27.(1)溶液变成紫红色,0.25 (2) ,
, w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
28.(1)硫 (2) ;
;
(3) ,可能含有
,可能含有 (4)
(4) 、
、 、
、 、
、 和
和 、
、 和
和
(5) 、
、 、
、
29.解析:①溶液中 被完全沉淀出后,
被完全沉淀出后, 才开始沉淀.图中曲线第二段为平行直线,沉淀总物质的量没有增减.故这段是因
才开始沉淀.图中曲线第二段为平行直线,沉淀总物质的量没有增减.故这段是因 的溶解和
的溶解和 的继续生成导致,且溶解的
的继续生成导致,且溶解的 的物质的量和生成的
的物质的量和生成的 物质的量相等.故加入的物质:
物质的量相等.故加入的物质:
 这段的离子方程式为:
这段的离子方程式为:


②第一段生成的沉淀为 、
、 和
和 ,且B为90 mL时,
,且B为90 mL时, 、
、 恰好沉淀完全.这段反应的离子方程式为:
恰好沉淀完全.这段反应的离子方程式为: ,
,
 ,
,
③图中曲线第三段(100-110 mL),B为100 mL时 恰好沉淀完全.这段中
恰好沉淀完全.这段中 继续溶解,B为110 mL时,沉淀中
继续溶解,B为110 mL时,沉淀中 已完全溶解.这段中溶解了
已完全溶解.这段中溶解了 ,消耗了10 mL NaOH,故
,消耗了10 mL NaOH,故 ,则100 mL时,共加入
,则100 mL时,共加入 为0.1 mol,共生成
为0.1 mol,共生成 ,故A溶液中
,故A溶液中 .这段
.这段 溶解的离子方程式为:
溶解的离子方程式为:
④图中曲线第四段中,沉淀为 、
、 共0.11 mol,则
共0.11 mol,则
 为0.11 mol,A中
为0.11 mol,A中 .
.
⑤第二、三段间共消耗 ,则共溶解的
,则共溶解的 为0.02 mol,则A中
为0.02 mol,则A中 .w.w.w.k.s.5.u.c.o.m
.w.w.w.k.s.5.u.c.o.m
30.(1) ;
;
(2) ;
; ;
; ,
,

(3) ;
; ;
; ,
,
(4) ;
;
(5)
(6)
 www.ks5u.com
www.ks5u.com
(1)瑞典科家舍勒在研究软锰矿(主要成份为MnO2)时,将浓盐酸与软锰矿混合加热,产生了一种有刺激性气味的有色气体.写出该反应的化学方程式,并标出电子转移方向和数目:


(2)某校合作学习探究小组学习科学家探究精神对氯气性质进行了探究,设计了以下一些实验.
| 实验内容 | 实验现象 | |
| A | 收集一集气瓶气体,观察颜色,然后向瓶内倒入约占瓶容积1/5的蒸馏水,充分振荡. | 蒸馏水呈浅黄绿色,瓶内气体仍呈黄绿色. |
| B | 取出瓶内部分溶液,滴入紫色石蕊试液中直至过量. | 紫色石蕊试液先变红色,后红色褪色. |
| C | 取出瓶内剩下的部分溶液,滴入硝酸银溶液中. | 产生大量白色沉淀 |
| D | 最后向瓶内倒入少量浓氢氧化钠溶液,振荡. | 瓶内黄绿色气体立即消失. |
②写出实验D中所发生反应的离子方程式
(3)该校另一合作学习探究小组用下列如图1所示装置对铜与硝酸反应进行探究.
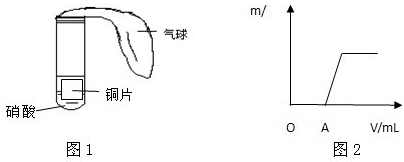
①甲同学观察到试管中的气体由无色变成了红棕色,由此认为试管里的硝酸是浓硝酸,你认为他的看法正确吗?
②乙同学向反应完成后的溶液里滴加氢氧化钠溶液,产生的沉淀(m/g)和加入溶液的体积(V/mL)的关系如图2所示.请写出O-A段反应的离子方程式
|
下列溶液中有关微粒的物质的量浓度关系正确的是 | |
| [ ] | |
A. |
0.1 mol/L的(CH3COO)2Ba溶液中:C(Ba2+)+C(H+) |
B. |
常温下,向醋酸钠溶液中滴加稀盐酸,至溶液呈中性;则混合液中:C(Cl-)>C(Na+)>C(CH3COOH) |
C. |
相同条件下,物质的量浓度相同的①氯化铵溶液;②醋酸溶液;③稀盐酸;溶液中由水电离出来的C(H+):①>③>② |
D. |
PH相等的:①NH4HSO4溶液;②NH4Cl溶液;③(NH4)2SO4溶液,溶液中 C(NH4+):②=③>① |
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看做是化学平衡的一种.请根据所学化学知识回答下列问题:
Ⅰ、已知0.01 mol/L的NaHCO3溶液呈碱性.
(1)
该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:①________
②________
③________
.(2)
溶液中共有________种不同的粒子(指分子和离子).(3)该溶液中的离子浓度由大到小的顺序是:________.
(4)向该溶液中加入AlCl3溶液,有白色胶状沉淀生成,同时产生一种无色无味并能使澄清石灰水变浑浊的气体,写出该反应的离子方程式:________.
Ⅱ、有盐酸、硫酸、醋酸三种溶液,试回答:
(1)若三种溶液的浓度均为0.1 mol·L-1,其c(H+)依次为a mol·L-1,b mol·L-1,c mol·L-1,其大小顺序为________;中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次是V1 L、V2 L、V3 L,其大小关系为________.
(2)若三种溶液的pH都为2,分别取10 mL上述溶液加水稀释至1000 mL,此时三种溶液的pH1、pH2、pH3之间的关系为________(用“<”、“>”或“=”表示,pH1-代表盐酸、pH2-代表硫酸、pH3-代表醋酸)
Ⅲ、已知含有足量AgCl固体的饱和溶液中存在如下平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq),
Ag+(aq)+Cl-(aq),
且在25℃时,AgCl的K sp=1.8×10-10.现将足量AgCl固体分别放入下列液体中:
①100 mL蒸馏水
②100 mL0.3 mol/L AgNO3溶液
③100 mL0.1 mol/L MgCl2溶液充分搅拌后冷却到25℃时,此时c(Ag+)由大到小的顺序为________(填序号),溶液②中c(Cl-)=________.
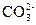
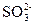
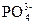 ?
?