网址:http://m.1010jiajiao.com/timu_id_499807[举报]
1.C 2.C 3.D 4.B 5.B 6.A 7.AD 8.AC 9.BD 10.AC 11.C
12.D 13.AC 14.D 15.B 16.D 17.B 18.B 19.A 20.D 21.D 22.B
23.(1) ;
; ;生成了弱电解质
;生成了弱电解质 ,破坏了
,破坏了 的溶解平衡.
的溶解平衡.
(2)①


②
24.(1) 在溶液中存在
在溶液中存在 的电离,
的电离,

 ,同时还存在
,同时还存在 离子的水解,
离子的水解,

 ,
, 溶液呈弱碱性,说明
溶液呈弱碱性,说明 的水解反应占优势.
的水解反应占优势.
(2) 在溶液中存在着
在溶液中存在着 离子的电离,同时又存在
离子的电离,同时又存在 离子的水解,
离子的水解, 呈弱酸性说明
呈弱酸性说明 离子的电离比水解来得强.
离子的电离比水解来得强.
(3)
25.A: B:
B: C:
C: D:
D: E:
E:
① ②
② ③
③
④
26.(1)粉红 


(2)放出气体,溶液变浑浊,红色加深红

27.(1)溶液变成紫红色,0.25 (2) ,
, w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
28.(1)硫 (2) ;
;
(3) ,可能含有
,可能含有 (4)
(4) 、
、 、
、 、
、 和
和 、
、 和
和
(5) 、
、 、
、
29.解析:①溶液中 被完全沉淀出后,
被完全沉淀出后, 才开始沉淀.图中曲线第二段为平行直线,沉淀总物质的量没有增减.故这段是因
才开始沉淀.图中曲线第二段为平行直线,沉淀总物质的量没有增减.故这段是因 的溶解和
的溶解和 的继续生成导致,且溶解的
的继续生成导致,且溶解的 的物质的量和生成的
的物质的量和生成的 物质的量相等.故加入的物质:
物质的量相等.故加入的物质:
 这段的离子方程式为:
这段的离子方程式为:


②第一段生成的沉淀为 、
、 和
和 ,且B为90 mL时,
,且B为90 mL时, 、
、 恰好沉淀完全.这段反应的离子方程式为:
恰好沉淀完全.这段反应的离子方程式为: ,
,
 ,
,
③图中曲线第三段(100-110 mL),B为100 mL时 恰好沉淀完全.这段中
恰好沉淀完全.这段中 继续溶解,B为110 mL时,沉淀中
继续溶解,B为110 mL时,沉淀中 已完全溶解.这段中溶解了
已完全溶解.这段中溶解了 ,消耗了10 mL NaOH,故
,消耗了10 mL NaOH,故 ,则100 mL时,共加入
,则100 mL时,共加入 为0.1 mol,共生成
为0.1 mol,共生成 ,故A溶液中
,故A溶液中 .这段
.这段 溶解的离子方程式为:
溶解的离子方程式为:
④图中曲线第四段中,沉淀为 、
、 共0.11 mol,则
共0.11 mol,则
 为0.11 mol,A中
为0.11 mol,A中 .
.
⑤第二、三段间共消耗 ,则共溶解的
,则共溶解的 为0.02 mol,则A中
为0.02 mol,则A中 .w.w.w.k.s.5.u.c.o.m
.w.w.w.k.s.5.u.c.o.m
30.(1) ;
;
(2) ;
; ;
; ,
,

(3) ;
; ;
; ,
,
(4) ;
;
(5)
(6)
 www.ks5u.com
www.ks5u.com
在pH=1的无色透明溶液中,不能大量共存的离子组是:
A.Al3+、Ag+、NO3-、I- B.Mg2+、NH4+、NO3-、Cl-
C.NH4+、K+、S2-、Br- D.Zn2+、Na+、NO3-、SO42-
查看习题详情和答案>>某pH=1的工业废液,只可能含有以下离子中的若干种:H+、Mg2+、Ba2+、Cl-、CO32-、SO42-,现取两份100 mL溶液进行如下实验:
第一份加入足量AgNO3溶液,得干燥沉淀3.50 g。
第二份加足量BaCl2溶液后,得干燥沉淀2.33 g,经足量盐酸洗涤、干燥后,沉淀质量不变。
根据上述实验,以下推测正确的是( )
①一定存在Mg2+ ②可能存在CO32- ③一定存在Cl- ④可能存在Ba2+ ⑤可能存在Mg2+
A.①③ B.②③ C.③⑤ D.④⑤
查看习题详情和答案>>
| A.Al3+、Ag+、NO3-、I- | B.Mg2+、NH4+、NO3-、Cl- |
| C.NH4+、K+、S2-、Br- | D.Zn2+、Na+、NO3-、SO42- |
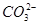 、
、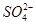 ,现取两份100 mL溶液进行如下实验:
,现取两份100 mL溶液进行如下实验: