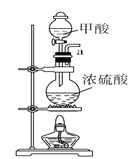
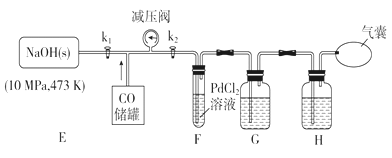
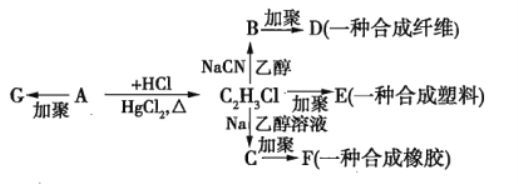
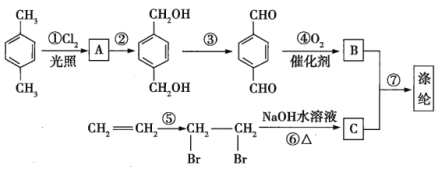
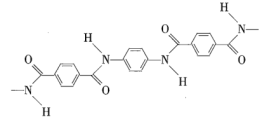
【题目】利用碳和水蒸气制备水煤气的核心反应为:C(s)+H2O(g)H2(g)+CO(g)
(1)已知碳(石墨)、H2、CO的燃烧热分别为393.5kJ·mol-1、285.8kJ·mol-1、283kJ·mol-1,又知H2O(l)=H2O(g) ΔH=+44kJ·mol-1,则C(s)+H2O(g)CO(g)+H2(g) ΔH=___。
(2)在某温度下,在体积为1L的恒容密闭刚性容器中加入足量活性炭,并充入1mol H2O(g)发生上述反应,反应时间与容器内气体总压强的数据如表:
时间/min | 0 | 10 | 20 | 30 | 40 |
总压强/100kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
①平衡时,容器中气体总物质的量为________mol,H2O的转化率为________。
②该温度下反应的平衡分压常数Kp=________kPa(结果保留2位有效数字)。
(3)保持25℃、体积恒定的1L容器中投入足量活性炭和相关气体,发生可逆反应C+H2O(g)CO+H2并已建立平衡,在40 min时再充入一定量H2,50min时再次达到平衡,反应过程中各物质的浓度随时间变化如图所示:
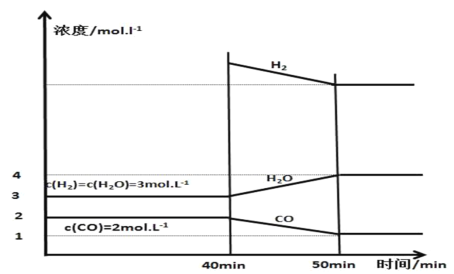
①40min时,再充入的H2的物质的量为________mol。
②40~50 min内H2的平均反应速率为________mol·L-1·min-1。
(4)新型的钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图所示:
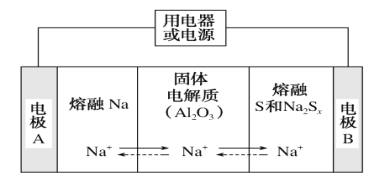
①放电时,电极A为________极,S发生________反应(填“氧化”或“还原”)。
②充电时,总反应为Na2Sx=2Na+Sx(3<x<5),Na所在电极与直流电源________极相连,阳极的电极反应式为_________。