题目内容
【题目】甲酸(化学式HCOOH,分子式CH2O2,相对分子质量46),俗名蚁酸,是最简单的羧酸,无色而有刺激性气味的易挥发液体。熔点为8.6 ℃,沸点100.8℃,25℃电离常数Ka=1.8×10-4。某化学兴趣小组进行以下实验。
Ⅰ.用甲酸和浓硫酸制取一氧化碳
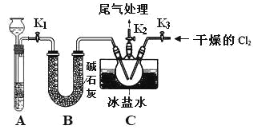
A. 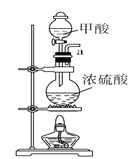 B.
B. 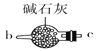 C.
C. 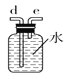 D.
D. 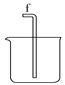
(1)请说出图B中盛装碱石灰的仪器名称__________。用A图所示装置进行实验。利用浓硫酸的脱水性,将甲酸与浓硫酸混合,甲酸发生分解反应生成CO,反应的化学方程式是________;实验时,不需加热也能产生CO,其原因是_______。
(2)如需收集CO气体,连接上图中的装置,其连接顺序为:a→__________(按气流方向,用小写字母表示)。
Ⅱ.对一氧化碳的化学性质进行探究
资料:ⅰ.常温下,CO与PdCl2溶液反应,有金属Pd和CO2生成,可用于检验CO;
ⅱ.一定条件下,CO能与NaOH固体发生反应:CO+NaOH![]() HCOONa
HCOONa
利用下列装置进行实验,验证CO具有上述两个性质。
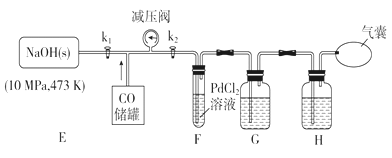
(3)打开k2,F装置中发生反应的化学方程式为_____________;为了使气囊收集到纯净的CO,以便循环使用,G装置中盛放的试剂可能是_________,H装置的作用是____________。
(4)现需验证E装置中CO与NaOH固体发生了反应,某同学设计下列验证方案:取少许固体产物,配置成溶液,在常温下测该溶液的pH,若pH>7,证明CO与NaOH固体发生了反应。该方案是否可行,请简述你的观点和理由:________,_________。
(5)25℃甲酸钠(HCOONa)的水解平衡常数Kh的数量级为____________。若向100ml 0.1mol.L-1的HCOONa溶液中加入100mL0.2mol.L-1的HCl溶液,则混合后溶液中所有离子浓度由大到小排序为_________。
【答案】球形干燥管 HCOOH CO↑+H2O 浓硫酸与甲酸混合时放出大量的热 c→b→e→d→f PdCl2+CO+H2O=Pd↓+CO2+2HCl 氢氧化钠溶液 除去CO中水蒸气 方案不可行 无论CO与NaOH固体是否发生反应,溶液的pH均大于7 10-11 c(Cl-)>c(H+)>c(Na+)>c(HCOO-)>c(OH-)
CO↑+H2O 浓硫酸与甲酸混合时放出大量的热 c→b→e→d→f PdCl2+CO+H2O=Pd↓+CO2+2HCl 氢氧化钠溶液 除去CO中水蒸气 方案不可行 无论CO与NaOH固体是否发生反应,溶液的pH均大于7 10-11 c(Cl-)>c(H+)>c(Na+)>c(HCOO-)>c(OH-)
【解析】
A装置利用浓硫酸的脱水性制备CO,生成的CO中含有挥发出的甲酸气体,需要利用碱石灰除去甲酸,利用排水法收集CO,结合物质的性质和装置分析解答。
Ⅰ.(1)图B中盛装碱石灰的仪器名称是球形干燥管。用A图所示装置进行实验。利用浓硫酸的脱水性,将甲酸与浓硫酸混合,甲酸发生分解反应生成CO,根据原子守恒可知反应的化学方程式是HCOOH CO↑+H2O。由于浓硫酸与甲酸混合时放出大量的热,所以实验时,不需加热也能产生CO。
CO↑+H2O。由于浓硫酸与甲酸混合时放出大量的热,所以实验时,不需加热也能产生CO。
(2)根据以上分析可知如需收集CO气体,连接上图中的装置,其连接顺序为:a→c→b→e→d→f。
Ⅱ.(3)打开k2,由于常温下,CO与PdCl2溶液反应,有金属Pd和CO2生成,则F装置中发生反应的化学方程式为PdCl2+CO+H2O=Pd↓+CO2+2HCl;由于F装置中有二氧化碳和氯化氢生成,且二者都是酸性气体,则为了使气囊收集到纯净的CO,以便循环使用,G装置中盛放的试剂可能是氢氧化钠溶液。剩余的CO中还含有水蒸气,则H装置的作用是除去CO中水蒸气。
(4)由于无论CO与NaOH固体是否发生反应,溶液的pH均大于7,所以该方案不可行;
(5)25℃甲酸电离常数Ka=1.8×10-4,则25℃甲酸钠(HCOONa)的水解平衡常数Kh=![]() ,其数量级为10-11。若向100mL 0.1mol·L-1的HCOONa溶液中加入100mL 0.2mol·L-1的HCl溶液,反应后溶液中含有等物质的量浓度的甲酸、氯化钠、氯化氢,则混合后溶液中所有离子浓度由大到小排序为c(Cl-)>c(H+)>c(Na+)>c(HCOO-)>c(OH-)。
,其数量级为10-11。若向100mL 0.1mol·L-1的HCOONa溶液中加入100mL 0.2mol·L-1的HCl溶液,反应后溶液中含有等物质的量浓度的甲酸、氯化钠、氯化氢,则混合后溶液中所有离子浓度由大到小排序为c(Cl-)>c(H+)>c(Na+)>c(HCOO-)>c(OH-)。

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案