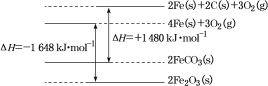
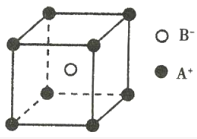
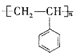
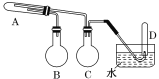
0 203339 203347 203353 203357 203363 203365 203369 203375 203377 203383 203389 203393 203395 203399 203405 203407 203413 203417 203419 203423 203425 203429 203431 203433 203434 203435 203437 203438 203439 203441 203443 203447 203449 203453 203455 203459 203465 203467 203473 203477 203479 203483 203489 203495 203497 203503 203507 203509 203515 203519 203525 203533 203614