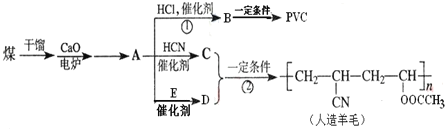
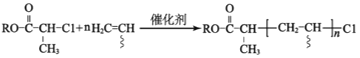
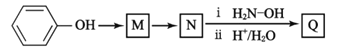
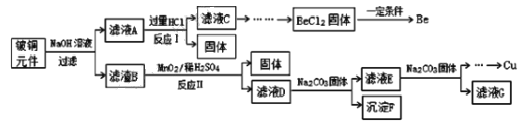
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某废旧铍铜元件(含25%BeO、71%CuS、少量 FeS和 SiO2)中回收铍和铜两种金属的工艺流程如图:
已知:
Ⅰ.铍、铝元素化学性质相似;
Ⅱ.常温下部分难溶物的溶度积常数如表:
难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
Ksp | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
(1)滤液A的成分除 NaOH、Na2BeO2外,还有________(填化学式),写出反应I中Na2BeO2,与过量盐酸反应的化学方程式:_________________。
(2)从滤液C 中提纯纯BeCl2,最合理的实验步骤顺序为_________(填字母)
a.加入过量的氨水 b.通入过量 CO2 c.加入过量NaOH溶液 d.加入适量HCl e.洗涤 f.过滤
(3)MnO2能将金属硫化物中的硫元素氧化为硫单质,写出反应Ⅱ中CuS发生反应的离子方程式:__________。若用浓HNO3溶解金属硫化物,缺点是________(任写一条)
(4)滤液D中c(Cu2+)= 2.2 molL-1、c(Fe3+) = 8.0×10 -3molL-1、c(Mn2+)= 0.01molL-1,逐滴加入 Na2CO3溶液调节pH 可将其转变成氢氧化物依次分离,首先沉淀的是______ (填离子符号)。为使铜离子开始沉淀,常温下应调节溶液的pH____4。
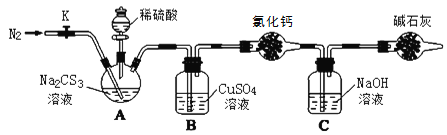
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图所示。已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH;②有关有机物物的沸点如下表:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
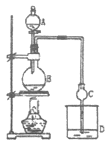
A中放醋酸,B中将过量的乙醇与少量浓硫酸混合,D中放有饱和碳酸钠溶液,经分液漏斗边滴加醋酸、边加热。
请回答:
(1)反应混合物的配制:圆底烧烧瓶中先加入___,再逐滴加入___,边加边振荡,___后,再加入醋酸。
(2)反应中加入的乙醇是过量的,其目的是___;浓硫酸的作用:①___;②___。
(3)该反应中,若用CH3CH218OH与乙酸发生反应,则反应的化学方程式为___。
(4)加热除了加快反应速率外还有一个重要的目的:___。
(5)在装置中,球形干燥管主要起到两个作用:一是起冷凝作用,二是:___。
(6)试管中盛放的是饱和碳酸钠溶液,它的作用是___(选填编号)。
A.中和乙酸和乙醇 B.吸收乙酸并溶解乙醇
C.降低乙酸乙酯的溶解度,有利于析出 D.加速乙酸乙酯的生成,提高其产率
(7)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出___;再加入___(此空从下列选项中选择),目的是___,然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
A.碱石灰 B.无水硫酸钠 C.生石灰
【题目】按要求填空
名称 | 结构简式 | ||
(1) | ___ | (6)最简单的有机物 | ___ |
(2) | ___ | (7)对氢气的相对密度为46的某芳香烃 | ___ |
(3) | ___ | (8)甘油 | ___ |
(4) | ___ | (9)最重要的化工石油水平衡量标准 | ___ |
(5)HCHO | ___ | (10)碳原子数在3-6的烷烃中其一氯代物只有一种 | ___ |