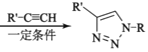
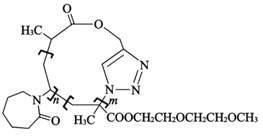
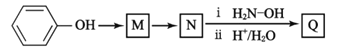
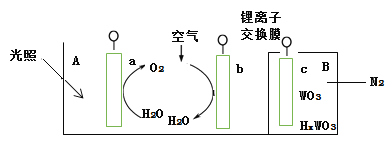
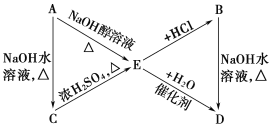
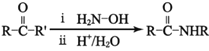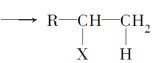题目内容
【题目】将0.2mol两种气态烃组成的混合气体,完全燃烧后得到6.72L二氧化碳(标准状况下)和7.2g水,下列说法正确的是( )
A.一定有乙烯烯B.一定有甲烷
C.一定没有甲烷D.一定没有乙烯
【答案】B
【解析】
根据![]() 计算7.2克水的物质的量,根据
计算7.2克水的物质的量,根据![]() 计算二氧化碳的物质的量,根据H原子、C原子守恒计算混合物的平均分子组成,据此判断:两种气态烃组成的混合物0.2mol完全燃烧得6.72L二氧化碳和7.2克水,7.2克水的物质的量为7.2g÷18g/mol=0.4mol,平均分子组成中H原子数目为:0.4mol×20.2mol=4,6.72L二氧化碳的物质的量=6.72L÷22.4L/mol=0.3mol,平均分子组成C原子数目为:0.3mol÷0.2mol=1.5,故该混合烃的平均分子式为C1.5H4,根据C原子可知,该烃一定含有CH4,根据H原子可知,另一烃的分子中H原子数目为4。
计算二氧化碳的物质的量,根据H原子、C原子守恒计算混合物的平均分子组成,据此判断:两种气态烃组成的混合物0.2mol完全燃烧得6.72L二氧化碳和7.2克水,7.2克水的物质的量为7.2g÷18g/mol=0.4mol,平均分子组成中H原子数目为:0.4mol×20.2mol=4,6.72L二氧化碳的物质的量=6.72L÷22.4L/mol=0.3mol,平均分子组成C原子数目为:0.3mol÷0.2mol=1.5,故该混合烃的平均分子式为C1.5H4,根据C原子可知,该烃一定含有CH4,根据H原子可知,另一烃的分子中H原子数目为4。
A.该混合烃的平均分子式为C1.5H4,可能有乙烯,故A错误;
B.该混合烃的平均分子式为C1.5H4,一定有甲烷CH4,故B正确;
C.一定有甲烷CH4,故C错误;
D.该混合烃的平均分子式为C1.5H4,可能有乙烯,故D错误;
答案选B。

练习册系列答案
相关题目