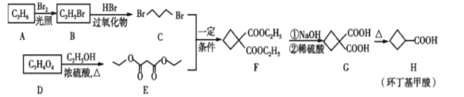
【题目】25 ℃时有关物质的颜色和溶度积(Ksp)如下表:
物质 | AgCl | AgBr | AgI | Ag2S |
颜色 | 白 | 淡黄 | 黄 | 黑 |
Ksp | 1.8×10-10 | 7.7×10-13 | 1.5×10-16 | 1.8×10-50 |
下列叙述中不正确的是( )
A.向AgCl的白色悬浊液中加入0.1 mol/L KI溶液,有黄色沉淀产生
B.25 ℃时,利用表中的溶度积(Ksp),可以计算AgCl、AgBr、AgI、Ag2S饱和水溶液中Ag+的浓度
C.25 ℃,AgCl固体分别在等物质的量浓度NaCl、CaCl2溶液中溶解达到平衡,两溶液中,c(Ag+)和溶度积均相同
D.在5 mL 1.8×10-6 mol/L NaCl溶液中,加入1滴(20滴约为1 mL)1×10-3 mol/L AgNO3溶液,不能产生白色沉淀
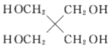
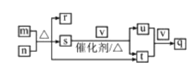
【题目】硼酸三丁酯的结构简式为B(OCH2CH2CH2CH3)3,常温常压下为略带香味的油状液体,是一种重要的含硼有机物,主要用作有机溶剂、脱水剂和催化剂,其一种实验室制备的原理为H3BO3+3CH3CH2CH2CH2OH![]() B(OCH2CH2CH2CH3)+3H2O,装置如图所示(夹持装置及微波加热装置已略去):
B(OCH2CH2CH2CH3)+3H2O,装置如图所示(夹持装置及微波加热装置已略去):
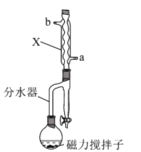
实验步骤如下:
Ⅰ.向微波专用圆底烧瓶中加入磁力搅拌子,并加入6.2 g硼酸(H3BO3)和47.4 mL正丁醇(CH3CH2CH2CH2OH)以及1.0 g NaHSO4H2O;
Ⅱ.微波加热:60℃下2 min,80℃下2 min,90℃下5 min,100℃下2 min,118℃下2 min;回流分水;
Ⅲ.待反应结束后,蒸馏得产品20.2 g。
已知:正丁醇的密度为0.81 g.cm-3。
请回答下列问题:
(1)分水器使用前需检查 ___,分水器的作用是 ___(任写一条)。
(2)图中仪器X的名称为 ___,其进水口应为____(填“a”或“b”)口。
(3)为了提高转化率,常用带水剂把生成的水从反应体系中分离出。分别以下列四种物质作为制备硼酸三丁酯的带水剂,结果如表所示,该实验选择正丁醇作带水剂,优点是____。
带水剂种类 | 甲苯 | 苯 | 环己烷 | 正丁醇 |
产率/% | 78.2 | 83.4 | 80.4 | 80.5 |
(4)步骤II中需要在不同温度下进行加热,并控制好时间,加热方式采用微波加热的优点是 ___;实验过程中发现,随着微波加热时间延长,硼酸三丁酯的产率增加,但当加热时间超过13 min后,产率增加幅度明显减小,造成此现象可能的原因是___。
(5)蒸馏装置中仪器的选择和安装均正确的是____(填选项字母)。
A. 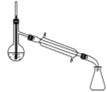 B.
B. 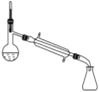 C.
C.  D.
D. 
(6)本实验中硼酸三丁酯的产率为____(保留三位有效数字)。
【题目】著名化学家徐光宪在稀土化学等领域取得了卓越成就,被誉为“稀土界的袁隆平”。稀土元素包括钪、钇和镧系元素。请回答下列问题:
(1)写出基态二价钪离子(Sc2+)的核外电子排布式____,其中电子占据的轨道数为 ____。
(2)在用重量法测定镧系元素和使镧系元素分离时,总是使之先转换成草酸盐,然后经过灼烧而得其氧化物,如2LnCl3+3H2C2O4+nH2O=Ln2(C2O4)3nH2O+6HCl。
①H2C2O4中碳原子的杂化轨道类型为____;1 mol H2C2O4分子中含σ键和π键的数目之比为 ___。
②H2O的VSEPR模型为 ___;写出与H2O互为等电子体的一种阴离子的化学式_______。
③HCI和H2O可以形成相对稳定的水合氢离子盐晶体,如HCl2H2O,HCl2H2O中含有H5O2+,结构为![]() ,在该离子中,存在的作用力有___________
,在该离子中,存在的作用力有___________
a.配位键 b.极性键 c.非极性键 d.离子键 e.金属键 f氢键 g.范德华力 h.π键 i.σ键
(3)表中列出了核电荷数为21~25的元素的最高正化合价:
元素名称 | 钪 | 钛 | 钒 | 铬 | 锰 |
元素符号 | Sc | Ti | V | Cr | Mn |
核电荷数 | 21 | 22 | 23 | 24 | 25 |
最高正价 | +3 | +4 | +5 | +6 | +7 |
对比上述五种元素原子的核外电子排布与元素的最高正化合价,你发现的规律是___________
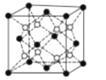
(4)PrO2(二氧化镨)的晶胞结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点。假设相距最近的Pr原子与O原子之间的距离为a pm,则该晶体的密度为_____gcm-3(用NA表示阿伏加德罗常数的值,不必计算出结果)。
【题目】减弱温室效应的方法之一是将CO2回收利用,科学家研究利用回收的CO2制取甲醛,反应的热化学方程式为CO2(g)+2H2(g)CH2O(g)+H2O(g) H。请回答下列问题:
(1)己知:
①CH2O(g)+O2(g)=CO2(g)+H2O(g) H1=-480kJ/mol
②相关化学键的键能数据如表所示:
化学键 | O=O | H-H | O-H |
键能/kJmol-1 | 498 | 436 | 464 |
则CO2(g)+2H2(g)CH2O(g)+H2O(g) H=____________
(2)一定条件下,将n(CO2):n(H2)=1:2的混合气体充入恒温恒容的密闭容器中,发生反应CO2(g)+2H2(g)CH2O(g)+H2O(g)。
①下列说明反应已经达到平衡状态的是____(填选项字母)。
a.容器内气体密度保持不变 b.H2O的体积分数保持不变
c.该反应的平衡常数保持不变 d.混合气体的平均相对分子质量不变
②下列措施既能提高H2的转化率又能加快反应速率的是_____填选项字母)
a.升高温度 b.使用高效催化剂 c.缩小容器体积 d.扩大容器体积
(3)实验室在2L密闭容器中进行模拟上述合成CH2O的实验。T1℃时,将体积比为1:4的CO2和H2混合气体充入容器中,每隔一定时间测得容器内气体压强如表所示:
时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
压强/kPa | 1.08 | 0.96 | 0.88 | 0.82 | 0.80 | 0.80 | 0.80 |
①已知:vp(B)=![]() 则反应开始10 min内,用H2的压强变化表示该反应的平均反应速率为 ___kPamin-1。
则反应开始10 min内,用H2的压强变化表示该反应的平均反应速率为 ___kPamin-1。
②T1℃时,反应的平衡常数Kp的代数式为Kp=_______kPa-1(Kp为用各气体分压表示的平衡常数,分压=总压×物质的量分数)。
(4)T2℃时,向体积为2L的恒容密闭容器中充入一定量的H2和CO2的混合气体,容器内气体压强为1.2 kPa,反应达到平衡时,CH2O的分压与起始的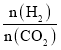 关系如图所示:
关系如图所示:
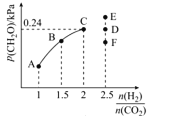
①当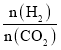 =2时,反应达到平衡后,若再向容器中加入CO2(g)和H2O(g),使二者分压均增大0.05 kPa,则达到新平衡时,H2的转化率将_______(填“增大”“减小”或“不变”)。
=2时,反应达到平衡后,若再向容器中加入CO2(g)和H2O(g),使二者分压均增大0.05 kPa,则达到新平衡时,H2的转化率将_______(填“增大”“减小”或“不变”)。
②当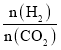 =2.5时,达到平衡状态后,CH2O的分压可能是图象中的点____(填“D”“E”或“F”),原因为_______
=2.5时,达到平衡状态后,CH2O的分压可能是图象中的点____(填“D”“E”或“F”),原因为_______