题目内容
【题目】减弱温室效应的方法之一是将CO2回收利用,科学家研究利用回收的CO2制取甲醛,反应的热化学方程式为CO2(g)+2H2(g)CH2O(g)+H2O(g) H。请回答下列问题:
(1)己知:
①CH2O(g)+O2(g)=CO2(g)+H2O(g) H1=-480kJ/mol
②相关化学键的键能数据如表所示:
化学键 | O=O | H-H | O-H |
键能/kJmol-1 | 498 | 436 | 464 |
则CO2(g)+2H2(g)CH2O(g)+H2O(g) H=____________
(2)一定条件下,将n(CO2):n(H2)=1:2的混合气体充入恒温恒容的密闭容器中,发生反应CO2(g)+2H2(g)CH2O(g)+H2O(g)。
①下列说明反应已经达到平衡状态的是____(填选项字母)。
a.容器内气体密度保持不变 b.H2O的体积分数保持不变
c.该反应的平衡常数保持不变 d.混合气体的平均相对分子质量不变
②下列措施既能提高H2的转化率又能加快反应速率的是_____填选项字母)
a.升高温度 b.使用高效催化剂 c.缩小容器体积 d.扩大容器体积
(3)实验室在2L密闭容器中进行模拟上述合成CH2O的实验。T1℃时,将体积比为1:4的CO2和H2混合气体充入容器中,每隔一定时间测得容器内气体压强如表所示:
时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
压强/kPa | 1.08 | 0.96 | 0.88 | 0.82 | 0.80 | 0.80 | 0.80 |
①已知:vp(B)=![]() 则反应开始10 min内,用H2的压强变化表示该反应的平均反应速率为 ___kPamin-1。
则反应开始10 min内,用H2的压强变化表示该反应的平均反应速率为 ___kPamin-1。
②T1℃时,反应的平衡常数Kp的代数式为Kp=_______kPa-1(Kp为用各气体分压表示的平衡常数,分压=总压×物质的量分数)。
(4)T2℃时,向体积为2L的恒容密闭容器中充入一定量的H2和CO2的混合气体,容器内气体压强为1.2 kPa,反应达到平衡时,CH2O的分压与起始的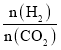 关系如图所示:
关系如图所示:
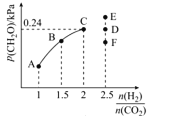
①当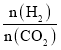 =2时,反应达到平衡后,若再向容器中加入CO2(g)和H2O(g),使二者分压均增大0.05 kPa,则达到新平衡时,H2的转化率将_______(填“增大”“减小”或“不变”)。
=2时,反应达到平衡后,若再向容器中加入CO2(g)和H2O(g),使二者分压均增大0.05 kPa,则达到新平衡时,H2的转化率将_______(填“增大”“减小”或“不变”)。
②当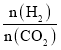 =2.5时,达到平衡状态后,CH2O的分压可能是图象中的点____(填“D”“E”或“F”),原因为_______
=2.5时,达到平衡状态后,CH2O的分压可能是图象中的点____(填“D”“E”或“F”),原因为_______
【答案】-6 KJ·mol-1 bd c 0.024 ![]() 增大 F 当反应物按化学计量数之比投料,达到平衡时生成物的百分含量最大,当
增大 F 当反应物按化学计量数之比投料,达到平衡时生成物的百分含量最大,当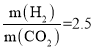 时,达到平衡状态后,CH2O的体积分数应小于C点,故可能是图像中的F点
时,达到平衡状态后,CH2O的体积分数应小于C点,故可能是图像中的F点
【解析】
(1)分析反应物和生成物存在的化学键形式,再根据H=反应物总键能-生成物总键能可求出反应O2(g)+2H2(g)2 H2O(g)的H,进而再根据盖斯定律可求出最终的结果;
(2)判断反应是否达到平衡的关键在于变量和不变量的判定,据此分析所给选项是否为变量即可选出答案;而既能提高H2的转化率又能加快反应速率需综合考虑化学反应速率的影响因素和平衡移动的影响因素;
(3)根据图中数据,再结合三段式,便可求出速率和平衡常数;
(4)根据压强对平衡移动的影响和勒夏特列原理分析可知H2的转化率将增大;再结合图像分析,当反应物按化学计量数之比投料,达到平衡时生成物的百分含量最大,当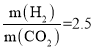 时,达到平衡状态后,CH2O的体积分数应小于C点,故可能是图像中的F点;
时,达到平衡状态后,CH2O的体积分数应小于C点,故可能是图像中的F点;
(1) 根据H=反应物总键能-生成物总键能,反应O2(g)+2H2(g)2H2O(g)的H2=(498+2×436)-(4×464)=-486kJ/mol,而由盖斯定律,反应CH2O(g)+O2(g)=CO2(g)+H2O(g) H1=-480kJ/mol与反应O2(g)+2H2(g)2H2O(g)相减即可得到目标反应,故H=H2-H1=-6kJ/mol,答案为:-6kJ/mol;
(2)①a.在恒温恒容的密闭容器中,体积始终不发生改变,根据![]() 可知,容器内气体密度为不变量,故a不可以;
可知,容器内气体密度为不变量,故a不可以;
b.H2O的体积分数保持不变,各物质的浓度保持不变,反应达到平衡状态,故b可以;
c.温度不变,反应平衡常数始终不变,为不变量,c不可以;
d.根据化学计量数反应前后不等,![]() 可知,气体的平均摩尔质量也为变量,可以作为达到平衡的标志,d可以;
可知,气体的平均摩尔质量也为变量,可以作为达到平衡的标志,d可以;
故选bd;
②a.升高温度反应速率增大,但因为H <0,升高温度,平衡逆向移动,H2转化率降低,不满足题意;
b.使用高效催化剂不改变转化率,b不满足题意;
c.缩小容器体积相当于增大压强,反应速率加快,平衡向体积减小的方向进行,即正向移动,H2的转化率增大,满足题意;
d.扩大容器体积,浓度减小,反应速率降低,不满足题意;
故选c;
(3)T1℃时,起始总压强为1.08kPa,由CO2和H2的体积比为1:4可得,CO2和H2的分压为![]() =0.216和
=0.216和![]() =0.864,容器体积不变,根据PV=nRT,分压与物质的量成正比,则有:
=0.864,容器体积不变,根据PV=nRT,分压与物质的量成正比,则有:
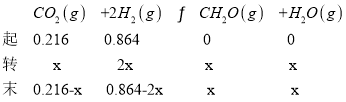
10min时,(0.216-x)+(0.864-2x)+x+x=0.96,则x=0.12,用H2的压强变化表示该反应的平均反应速率为![]() kPamin-1;平衡时,(0.216-x)+(0.864-2x)+x+x=0.80,则x=0.28,反应的平衡常数Kp的代数式为
kPamin-1;平衡时,(0.216-x)+(0.864-2x)+x+x=0.80,则x=0.28,反应的平衡常数Kp的代数式为![]() ,故答案为:0.024;
,故答案为:0.024;![]() ;
;
(4)①当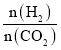 =2时,反应达到平衡后,若再向容器中加入CO2(g)和H2O(g),使二者分压均增大0.05 kPa,平衡正向移动,则H2的转化率增大,结合图像分析,当反应物按化学计量数之比投料,达到平衡时生成物的百分含量最大,当
=2时,反应达到平衡后,若再向容器中加入CO2(g)和H2O(g),使二者分压均增大0.05 kPa,平衡正向移动,则H2的转化率增大,结合图像分析,当反应物按化学计量数之比投料,达到平衡时生成物的百分含量最大,当 时,达到平衡状态后,CH2O的体积分数应小于C点,故可能是图像中的F点;故答案为:增大;F;当反应物按化学计量数之比投料,达到平衡时生成物的百分含量最大,当
时,达到平衡状态后,CH2O的体积分数应小于C点,故可能是图像中的F点;故答案为:增大;F;当反应物按化学计量数之比投料,达到平衡时生成物的百分含量最大,当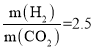 时,达到平衡状态后,CH2O的体积分数应小于C点,故可能是图像中的F点。
时,达到平衡状态后,CH2O的体积分数应小于C点,故可能是图像中的F点。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案【题目】25 ℃时有关物质的颜色和溶度积(Ksp)如下表:
物质 | AgCl | AgBr | AgI | Ag2S |
颜色 | 白 | 淡黄 | 黄 | 黑 |
Ksp | 1.8×10-10 | 7.7×10-13 | 1.5×10-16 | 1.8×10-50 |
下列叙述中不正确的是( )
A.向AgCl的白色悬浊液中加入0.1 mol/L KI溶液,有黄色沉淀产生
B.25 ℃时,利用表中的溶度积(Ksp),可以计算AgCl、AgBr、AgI、Ag2S饱和水溶液中Ag+的浓度
C.25 ℃,AgCl固体分别在等物质的量浓度NaCl、CaCl2溶液中溶解达到平衡,两溶液中,c(Ag+)和溶度积均相同
D.在5 mL 1.8×10-6 mol/L NaCl溶液中,加入1滴(20滴约为1 mL)1×10-3 mol/L AgNO3溶液,不能产生白色沉淀