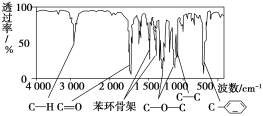
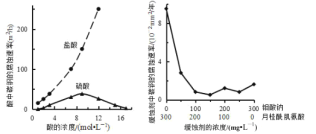
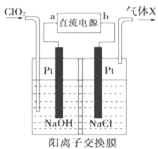
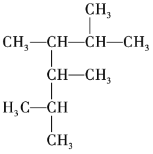
【题目】一定温度下,在 3个体积均为 20L的密闭真空容器中发生如下反应(假设容器体积不变,固体试样体积忽略不计):NH2COONH4(s)![]() 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据如表所示:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据如表所示:
容器 | 温度/℃ | 起始物质的量(n/mol) | 平衡物质的量(n/mol) | ||
n(NH2COONH4) | n(NH3) | n(CO2) | n(CO2) | ||
I | 15 | 1.00 | 0 | 0 | 0.016 |
II | 15 | 2.00 | 0 | 0 | a |
III | 35 | 0 | 4.00 | 2.00 | b |
下列说法不正确的是
A.当反应进行到30min时测得容器Ⅰ中混合气体的物质的量为 0.036mol,则30min 内该反应的平均速率 v(NH3)=4×10-5mol·L-1·min-1
B.当密闭容器中的二氧化碳的体积分数不变时,不能说明该反应到达了平衡
C.若该反应的正反应为吸热反应,则 b一定大于0.032
D.达到平衡时反应物的转化率:α(Ⅰ)> α (Ⅱ)