题目内容
【题目】NaClO2(亚氯酸钠)是常用的消毒剂和漂白剂,工业上可采用电解法制备,工作原理如图所示。下列叙述正确的是
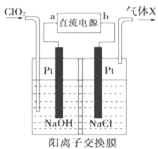
A.若直流电源为铅蓄电池,则b极为Pb
B.交换膜左侧 NaOH 的物质的量不变,气体X为Cl2
C.阳极反应式为ClO2+e-=ClO2-
D.制备 18.1 gNaClO2 时理论上有 0.2 molNa+由交换膜左侧向右侧迁移
【答案】B
【解析】
A. 二氧化氯转化为NaClO2( 亚氯酸钠)的过程是发生还原反应,应该发生在阴极,所以a是负极,b是正极,若直流电源为铅蓄电池,则电池的负极和电源的负极相连,b极为正极,应该是PbO2,A错误;
B. 阳离子交换膜只允许阳离子通过,所以交换膜左边NaOH的物质的量不变,在阳极上是Cl-失电子的氧化反应,产生的是Cl2,气体X为Cl2,B正确;
C. 在阳极上是Cl-失电子的氧化反应,产生的是氯气,C错误;
D. Na+由交换膜右侧向左侧迁移,D错误;
故合理选项是B。

练习册系列答案
相关题目