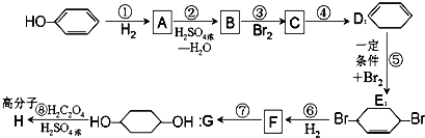
【题目】化学是一门以实验为基础的科学。
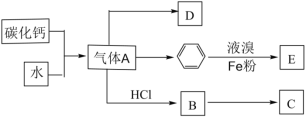
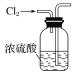
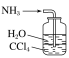
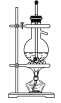
(1)用下列实验装置完成对应的实验(部分仪器略去),能达到实验目的的是________(填字母)。
A | B | C | D |
|
|
|
|
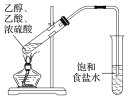
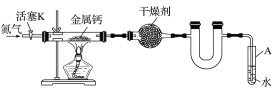
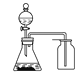
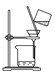
干燥氯气 | 吸收NH3 | 石油的分馏 | 制取乙酸乙酯 |
(2)为除去粗盐中的MgCl2、CaCl2、Na2SO4以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
![]()
①第Ⅰ步操作的名称是____________。
②若第Ⅱ、Ⅳ步顺序颠倒,是否会对实验结果产生影响?________(填“有影响”或“无影响”)。
③第Ⅴ步操作所需玻璃仪器的名称是____________。
【题目】氢叠氮酸(HN3)和莫尔盐[(NH4)2SO4·FeSO4·6H2O]是两种常用原料。
(1)氢叠氮酸易溶于水,25℃时,该酸的电离常数为Ka=10×10-5。
①氢叠氮酸在水溶液中的电离方程式为_______
②0.2mol/L的HN3溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃,此时,溶液呈酸性,则混合溶液中各离子和HN3分子浓度由大到小的顺序为_______。
(2)在FeSO4溶液中,加入(NH4)2SO4固体可制备莫尔盐晶体[(NH4)2Fe(SO4)2·6H2O],为了测定产品纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下:(已知莫尔盐的分子量为392)
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 25.52 | 25.02 | 24.98 |
①配制莫尔盐溶液,所使用的玻璃仪器除了烧杯和玻璃棒外还有_______
②滴定终点的现象是_______,通过实验数据,计算该产品的纯度为_______(用含字母a、c的式子表示)。
③上表第一次实验中记录数据明显大于后两次,其原因可能是_______。
A 第一次滴定时,锥形瓶用待装液润洗
B 该酸性高锰酸钾标准液保存时间过长,部分变质
C 滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
【题目】(1)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4 kJ/mol,其化学平衡常数K与温度t的关系如下表:
2NH3(g)△H=-92.4 kJ/mol,其化学平衡常数K与温度t的关系如下表:
t/K | 298 | 398 | 498 | ...... |
K/(mol/L)2 | 4.1×106 | K1 | K2 | ...... |
完成下列问题:
①比较K1、K2的大小:K1_______K2(填“>”、“=”或“<”);
②在恒温恒压下判断该反应达到化学平衡状态的依据是_______(填序号);
A 2v(H2)(正)=3v(NH3)(逆)
B 2v(N2)(正)=v(H2)(逆)
C 容器内压强保持不变
D 混合气体的密度保持不变
(2)工业上生产尿素的化学方程式为:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6molNH3和3molCO2,反应达到平衡时,c(NH3)=0.5mol·L-1,则该反应的平衡常数K=_______。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3molNH3,则此时反应的v正_______v逆(填“>”“<”或“=”)。
CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6molNH3和3molCO2,反应达到平衡时,c(NH3)=0.5mol·L-1,则该反应的平衡常数K=_______。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3molNH3,则此时反应的v正_______v逆(填“>”“<”或“=”)。
(3)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图所示。
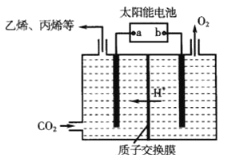
①该工艺中能量转化方式主要有_______。
②电解时,生成乙烯的电极反应式是_______。