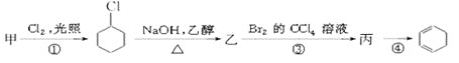
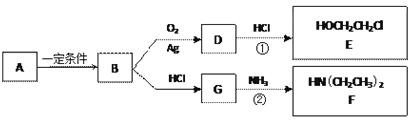
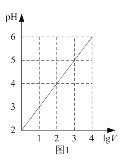
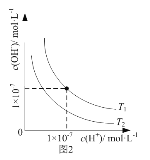
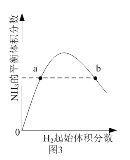
题目内容
【题目】NA表示阿伏加德罗常数的数值,下列说法不正确的是( )
A.将1molNH4NO3溶于一定浓度的稀氨水中,溶液呈中性,若不考虑挥发,溶液中一定含有NA个NH4+
B.1mol·L-1CH3COOH与1mol·L-1CH3COONa溶液等体积混合,溶液中CH3COOH和CH3COO-的总数为2NA
C.常温常压下,3.6gH2O中含有电子数为2NA
D.含有2NA个氧原子的氧气与臭氧的混合气体的质量为32g
【答案】B
【解析】
A.根据溶液的电中性可知:n(NH4+)+n(H+)=n(NO3-)+n(OH-),而由于溶液呈中性,可知n(H+)=n(OH-),故有n(NH4+)=n(NO3-),而n(NO3-)=1mol,故n(NH4+)=1mol,故A正确;
B.溶液的体积不知道,无法计算,故B错误;
C.3.6gH2O的物质的量n=![]() =
=![]() =0.2mol,而1molH2O含10mol电子,故0.2mol水中含2mol电子,个数为2NA个,故C正确;
=0.2mol,而1molH2O含10mol电子,故0.2mol水中含2mol电子,个数为2NA个,故C正确;
D.氧气和臭氧均由氧原子构成,2NA个氧原子的物质的量为2mol,质量m=nM=2mol×16g/mol=32g,故D正确;
故答案为B。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】某同学在实验室进行铁盐与亚铁盐相互转化的实验:
实验Ⅰ:将Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为:________________________________________。
(2)探究白色沉淀产生的原因,请填写实验方案:
实验方案 | 现象 | 结论 |
步骤1:取4mL_________mol/L CuSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 产生白色沉淀 | CuSO4与KSCN 反应产生了白色沉淀 |
步骤2:取_____________________________ | 无明显现象 |
查阅资料:ⅰ.SCN-的化学性质与I-相似 ⅱ.2Cu2++ 4 I-= 2CuI↓+ I2
则Cu2+与SCN-反应的离子方程式为________________________________________________。
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL 0.1mol/L FeSO4溶液中加入1 mL 8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++ NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因_______________________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行
反应Ⅰ:Fe2+与HNO3反应; 反应Ⅱ:Fe2+与NO反应
①依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ__________(填“快”或“慢”)。
②乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是______________________________。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因__________________________________。
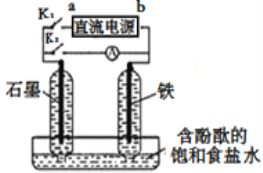
(5)丙认为若生成的NO与Fe2+不接触,溶液就不会出现棕色,请从以下提供的实验用品中选择合适的用品,设计实验方案,并画出实验装置图,标明试剂,实现Fe2+![]() Fe3+的转化,同时避免出现此异常现象。
Fe3+的转化,同时避免出现此异常现象。
实验用品:U形管、烧杯、导线、石墨棒若干、铁片若干、盐桥(装有含琼脂的KCl饱和溶液)、 0.1mol/L FeSO4溶液、8mol/L稀硝酸

____________