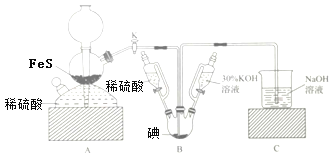
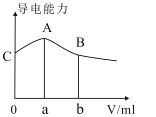
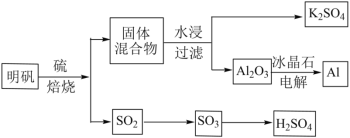
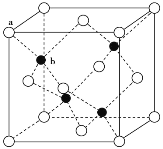
题目内容
【题目】氢叠氮酸(HN3)和莫尔盐[(NH4)2SO4·FeSO4·6H2O]是两种常用原料。
(1)氢叠氮酸易溶于水,25℃时,该酸的电离常数为Ka=10×10-5。
①氢叠氮酸在水溶液中的电离方程式为_______
②0.2mol/L的HN3溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃,此时,溶液呈酸性,则混合溶液中各离子和HN3分子浓度由大到小的顺序为_______。
(2)在FeSO4溶液中,加入(NH4)2SO4固体可制备莫尔盐晶体[(NH4)2Fe(SO4)2·6H2O],为了测定产品纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下:(已知莫尔盐的分子量为392)
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 25.52 | 25.02 | 24.98 |
①配制莫尔盐溶液,所使用的玻璃仪器除了烧杯和玻璃棒外还有_______
②滴定终点的现象是_______,通过实验数据,计算该产品的纯度为_______(用含字母a、c的式子表示)。
③上表第一次实验中记录数据明显大于后两次,其原因可能是_______。
A 第一次滴定时,锥形瓶用待装液润洗
B 该酸性高锰酸钾标准液保存时间过长,部分变质
C 滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
【答案】HN3H++N3- c(N3-)>c(Na+)>c(HN3+)>c(H+)>c(OH-) 500mL容量瓶,胶头滴管 滴入最后一滴标准液,溶液变为浅紫红色,且半分钟不变色 (980c/a)×100% AC
【解析】
(1)①氢叠氮酸是一元弱酸;
②0.2mol/L的HN3溶液与0.1mol/L的NaOH溶液等体积混合后,溶液中含有等物质的量浓度的HN3和NaN3;
(2)溶液的配置需要的仪器有:烧杯、玻璃棒、容量瓶、胶头滴管;高锰酸钾溶液本身是紫色的,可以根据高锰酸钾溶液颜色变化判断滴定终点;第一次实验中记录数据明显大于后两次,即高锰酸钾溶液体积偏大。
(1)①氢叠氮酸易溶于水,25℃时,该酸的电离常数为Ka=10×10-5,说明氢叠氮酸为弱酸,在水溶液中的电离方程式为HN3![]() H++N3-,故答案为HN3
H++N3-,故答案为HN3![]() H++N3-;
H++N3-;
②0.2mol/L的HN3溶液与0.1mol/L的NaOH溶液等体积混合后,溶液中存在等物质的量浓度的HN3和Na N3,恢复到25℃,溶液显酸性,以HN3的电离为主,混合溶液中各离子和HN3分子浓度由大到小的顺序为c(N3-)>c(Na+)>c(HN3)>c(H+)>c(OH-),故答案为c(N3-)>c(Na+)>c(HN3)>c(H+)>c(OH-);
(2) ①500mL溶液的配置需要的仪器有:烧杯、玻璃棒、容量瓶、胶头滴管,故答案为:500mL容量瓶,胶头滴管;
②利用高锰酸钾的强氧化性,Fe2+的强还原性,两者发生氧化还原反应,Fe2+被氧化成Fe3+,化合价升高1,Mn由+7价→+2,化合价降低5,最小公倍数5,根据原子个数、电荷守恒,配平得MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,向溶液中滴加中高锰酸钾,高锰酸钾显紫红色,因此滴定到终点:滴入最后一滴标准液,溶液由无色变为浅紫色,且30s不变色,故答案为:滴入最后一滴标准液,溶液由无色变为浅紫色,且30s不变色;因为第一次与第二次、第三次相差较大,忽略不计,消耗高锰酸钾溶液的体积为![]() mL=25mL,根据离子反应方程式,得出:n[(NH4)2SO4FeSO46H2O]=5n(KMnO4) =25×10-3×c×5mol,则500mL溶液中含有n[(NH4)2SO4FeSO46H2O] =25×10-3×c×5×500/25mol =2.5cmol,所以质量分数=2.5c×
mL=25mL,根据离子反应方程式,得出:n[(NH4)2SO4FeSO46H2O]=5n(KMnO4) =25×10-3×c×5mol,则500mL溶液中含有n[(NH4)2SO4FeSO46H2O] =25×10-3×c×5×500/25mol =2.5cmol,所以质量分数=2.5c×![]() ×100%=
×100%=![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%;
×100%;
③A.第一次滴定时,锥形瓶用待装液润洗,锥形瓶中亚铁离子的量偏多,消耗的高锰酸钾偏多,A项正确;B.三次使用的高锰酸钾都是一样的,消耗的高锰酸钾体积应是相同的,B项错误;C.滴定管尖嘴有气泡,滴定结束无气泡,所消耗的液体体积增加,故C项正确;故答案为:AC。

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案