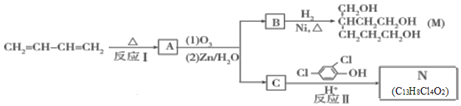
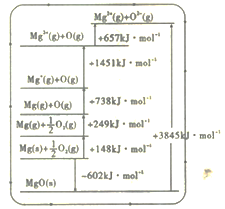
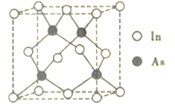
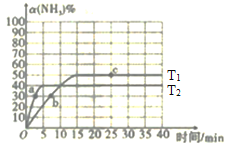
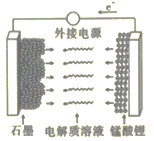
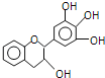
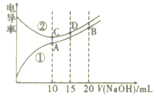
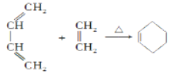0 202957 202965 202971 202975 202981 202983 202987 202993 202995 203001 203007 203011 203013 203017 203023 203025 203031 203035 203037 203041 203043 203047 203049 203051 203052 203053 203055 203056 203057 203059 203061 203065 203067 203071 203073 203077 203083 203085 203091 203095 203097 203101 203107 203113 203115 203121 203125 203127 203133 203137 203143 203151 203614