题目内容
【题目】电解质溶液的电导率越大,导电能力越强。用0. 100mol·L-1的NaOH溶液分别滴定10.00mL浓度均为0.100mol·L-1的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是
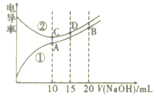
A.曲线②代表滴定CH3COOH溶液的曲线
B.在相同温度下,C、D两点溶液中水的电离程度: C>D
C.取A点溶液1mL加水稀释,溶液中的所有离子浓度都减小
D.B点溶液中: c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
【答案】B
【解析】
从曲线中可以看出,加入NaOH前,曲线②的电导率大,说明其为盐酸的电导率曲线;V(NaOH)=10mL时,盐酸、醋酸刚好完全反应,所以在A、C点酸与碱刚好完全反应。
A.由以上分析知,曲线②代表滴定盐酸溶液的曲线,A不正确;
B.在相同温度下,C点溶质为NaCl,D点溶质为NaCl和NaOH,由于NaOH电离产生的OH-抑制了水的电离,所以C、D两点溶液中水的电离程度:C>D,B正确;
C.A点的溶质为CH3COONa,取A点溶液1mL加水稀释,溶液中除去H+外,其它离子的浓度都减小,C不正确;
D.B点溶质为等浓度的CH3COONa和NaOH,离子浓度关系为: c(Na+)>c(OH-)>c(CH3COO-)>c(H+),D不正确;
故选B。

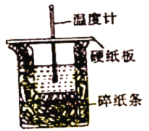
【题目】Ⅰ.(1)同学用50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液测定计算中和反应的反应热。回答下列向题:
从实验装置上看,图中缺少的一种玻璃用品是_______。如改用0.0275 mol NaOH固体与该盐酸进行实验,则实验中测得的“中和热”数值将___填“偏大”、“偏小”或“无影响”)。已知稀盐酸和NaOH稀溶液发生中和反应生成0.1 mol H2O时,放出5.73kJ的热量,则表示该反应中和热的热化学方程式为________。
(2)乙同学用另一装置将V1 mL 1.0 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50)。回答下列问题:
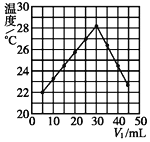
做该实验时,环境温度__(填“高于”、“低于”或“等于”)22℃。根据图计算该NaOH溶液的浓度约是__mol·L-1。
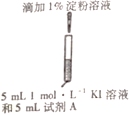
II.某研究小组对碘化钾溶液在空气中发生氧化反应的速率进行实验探究。
(初步探究)
示意图 | 序号 | 温度 | 试剂A | 现象 |
| ① | 0℃ | 0.5 mol·L-1稀硫酸 | 4min左右出现蓝色 |
② | 20℃ | 1min左右出现蓝色 | ||
③ | 20℃ | 0.1 mol·L-1 稀硫酸 | 15min左右出现蓝色 | |
④ | 20℃ | 蒸馏水 | 30min左右出现蓝色 |
(1)为探究量度对反应速率的影响,实验②中试剂A应为___。
(2)写出实验③中I-反应的离子方程式_____。
(3)对比实验②③④,可以得出的结论是_________。
(继续探究)溶液pH对反应速率的影响
查阅资料:
i.pH<11.7时,I-能被O2氧化为I2-。
ii.pH>9.28时,I2-发生歧化反应:3I2-+6OH-=IO3-+5I-+3H2O,pH越大,歧化速率越快
(4)小组同学用4支试管在装有O2储气瓶中进行实验,装置如图所示。
序号 | ⑤ | ⑥ | ⑦ | ⑧ |
试管中溶液的pH | 8 | 9 | 10 | 11 |
放置10小时后的现象 | 出现蓝色 | 颜色无明显变化 | ||
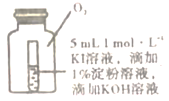
pH为10、11时,试管⑦和⑧中颜色无明显变化的原因是__(填序号)。
A 发生氧化反应又发生歧化反应,歧化反应速率大于氧化反应速率和淀粉变色速率
B 发生氧化反应又发生歧化反应,歧化反应速率小于氧化反应速率和淀粉变色速率
C 生了氧化反应,但没有发生歧化反应
D 生了歧化反应,但没有发生氧化反应
【题目】在一体积固定的密闭容器中,某化学反应2A(g)![]() B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如表:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如表:
实验序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800 | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800 | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)实验1中,在10~20min内,用A表示的该反应的平均速率为________mol·L-1·min-1。
(2)实验2中c2=________,反应经20min就达到平衡,可推测实验2中还隐含的条件是________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3______(填“>”“<”或“=”,下同)v1,且c3_____1.0。
(4)请根据以上实验指出要加快该反应速率可采取的方法:________。(至少列举2种方法)
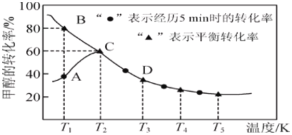
【题目】合成气经压缩升温后进入10m3的甲醇合成塔中,在催化剂的作用下进行甲醇合成,主要反应是:2H2(g) + CO(g)![]() CH3OH(g)+181.6kJ。已知:某温度下(设温度为T1℃)此反应的平衡常数为160。
CH3OH(g)+181.6kJ。已知:某温度下(设温度为T1℃)此反应的平衡常数为160。
(1)此温度下,在密闭容器中加入一定量的CO和H2,反应到某时刻测得各组分的浓度如表:
物质 | H2 | CO | CH3OH |
浓度/(mol/L) | 0.2 | 0.1 | 0.4 |
比较此时正、逆反应速率的大小:v正_______v逆 (填“>”、“<”或“=”);若加入与上述同样多的CO和H2,在T2℃条件下反应,10 min后达平衡时c(H2)=0.4mol/L,则该时间内反应速率v(CH3OH)=_______ mol/(L·min);
(2)在一定条件的密闭恒容的容器中,下列式子或文字描述能表示上述反应达到化学平衡状态的是_______(选填序号);
a.2v逆(CO) = v正(H2)
b.c(CO): c(H2):c(CH3OH) =1:2:1
c.混合气体的平均式量保持不变
d.混合气体的密度保持不变
(3)上述反应达到平衡后,下列说法正确的是_______(选填序号);
a.其他条件不变,增大压强,平衡常数K﹤160
b.其他条件不变,温度升高,平衡常数K会减小
c.其他条件不变,若同比例地增加CO和H2的量平衡不会发生移动
d.其他条件不变,增大甲醇的物质的量,正反应速率也会随之逐渐增大
(4)寻找合适的催化剂来改善上述合成甲醇的条件一直是研究课题。现分别对X、Y、Z三种催化剂进行如下实验(其他条件均相同):
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂并简述理由____。