题目内容
【题目】在合成氨工业和硝酸制备工业中,常产生N2O、NO和NO2等氮氧化物造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
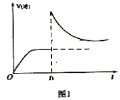
(1)在2L密闭容器中通入3mol H2和1mol N2,测得不同温度下,NH3的产率随时间的变化如图所示。
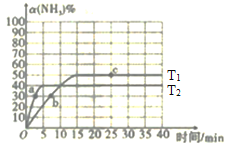
①下列有关说法正确的是________(填序号)。
A.a处的v正>0
B.e点的v净=0
C.由b点到c点混合气体相对分子质量逐渐增大
D.平衡时,通入氩气平衡正向移动
②T2温度时,0~5min内v(N2)=___mol·L-1·min-l
③已知:瞬时速率表达式v正=k正c3(H2)c(N2),v逆=k逆c2(NH3)(k为速率常数,只与温度有关)。温度由T1调到T2,活化分子百分率________。(填“增大”“减小”或“不变”),
k正增大倍数____k逆增大倍数(填“大于”“小于”或“等于”)。T1°C时,![]() ____
____
(2)工业生产尾气中产生的N2O需进行分解处理,用碘蒸气可大大提高N2O的分解速率,反应历程如下:
第一步:I2(g)=2I(g) (快反应)
第二步:I(g)+N2O(g)→N2(g)+IO(g) (慢反应)
第三步: IO(g)+N2O(g)→N2(g)+O2(g)+I(g) ( 快反应)
在反应过程中,I2的浓度与N2O分解速率_____ (填“有关”或“无关”);第___步反应对总反应速率起决定性作用;第二步的活化能比第三步____(填 “大”“小”或“相等”)。
(3)已除去N2O的硝酸尾气NO和NO2可用NaOH溶液吸收,写出NO和NO2与NaOH反应生成一种盐的反应方程式:_______;已知,常温下HNO2的电离常数Ka=5×10-4,则0.5mol/L对应钠盐的pH值为_______
【答案】AB 0.04 增大 小于 ![]() 或2.37 有关 二 大 NO+NO2+2NaOH==2NaNO2+H2O 8.5
或2.37 有关 二 大 NO+NO2+2NaOH==2NaNO2+H2O 8.5
【解析】
(1)①A.从图中可以看出,a处反应未达平衡,此时反应仍正向进行,;
B.e点时,反应达平衡状态;
C.由b点到拐点,反应正向进行,从拐点到c点,反应一直处于平衡状态;
D.平衡时,通入氩气,对平衡没有影响。
②T2温度时,由NH3的产率,可求0~5min内,N2浓度的变化量,从而求出v(N2)。
③温度由T1升高到T2,活化分子数增多,但平衡逆向移动,由此确定k正增大倍数与k逆增大倍数的关系。T1°C时,![]() K,由平衡点可进行计算。
K,由平衡点可进行计算。
(2)在反应过程中,从第二步看,I2的浓度大,则生成I(g)的浓度大,由反应式可确定与N2O分解速率关系;在反应中,慢反应对总反应速率起决定性作用;第二步反应慢,则活化能比第三步大。
(3)NO和NO2与NaOH反应生成一种NaNO2和水,由此可写出反应方程式;已知,常温下HNO2的电离常数Ka=5×10-4,利用水解方程式可求出0.5mol/L对应钠盐的pH。
(1)①A.从图中可以看出,a处反应未达平衡,此时反应仍正向进行,v正>0,A正确;
B.e点时,反应达平衡状态,v净=0,B正确;
C.由b点到拐点,反应正向进行,从拐点到c点,反应一直处于平衡状态,C不正确;
D.平衡时,通入氩气,对平衡没有影响,D不正确;
故选AB。答案为:AB;
②T2温度时,NH3的产率为40%,由N2的转化率为40%,0~5min内,N2的物质的量的变化量为1mol×40%=0.4mol,从而求出v(N2)=![]() =0.04 mol·L-1·min-l。答案为:0.04;
=0.04 mol·L-1·min-l。答案为:0.04;
③温度由T1升高到T2,活化分子数增大,但平衡逆向移动,由此确定k正增大倍数小于k逆增大倍数。
T1°C时,NH3的平衡转化率为50%,由此建立三段式为:

![]() K=
K=![]() =
=![]() 或2.37。答案为:增大;小于;
或2.37。答案为:增大;小于;![]() 或2.37;
或2.37;
(2)在反应过程中,从第二步看,I2的浓度大,则生成I(g)的浓度大,N2O分解速率大,与I(g)的浓度有关;在反应中,慢反应对总反应速率起决定性作用,则第二步反应对总反应速率起决定性作用;第二步反应慢,则活化能比第三步大。答案为:有关;二;大;
(3)NO和NO2与NaOH反应生成一种NaNO2和水,反应方程式为NO+NO2+2NaOH==2NaNO2+H2O;已知,常温下HNO2的电离常数Ka=5×10-4,水解方程式为NO2-+H2O![]() HNO2+OH-,可设平衡时c(OH-)=x,则Kh=
HNO2+OH-,可设平衡时c(OH-)=x,则Kh=![]() =
=![]() ,从而求出x=10-5.50.5mol/L对应钠盐的pH=8.5。答案为:NO+NO2+2NaOH==2NaNO2+H2O;8.5。
,从而求出x=10-5.50.5mol/L对应钠盐的pH=8.5。答案为:NO+NO2+2NaOH==2NaNO2+H2O;8.5。