【题目】(1)室温下,在0.5 mol/L的纯碱溶液中加入少量水,由水电离出的c(H+)·c(OH-)_______ (填“变大”、“变小”、“不变”)。
(2)已知Ksp(Ag2CrO4)=1.0×10-12,向0.2 moL的AgNO3溶液中加入等体积的0.08 mol/L K2CrO4溶液,则溶液中的c(CrO42-)=________。
(3)室温下,0.1 mol/L NaHCO3溶液的pH值________0.1 mol/LNa2SO3溶液的pH值(填“>”、“<”、“=”)。
已知:
酸 | 电离平衡常数 | |
H2CO3 | K1=4.3×10-7 | K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 | K2=1.02×10-7 |
(4)有一种可充电电池Na—Al/FeS,电池工作时Na+的物质的量保持不变,并且是用含![]() 的导电固体作为电解质,已知该电池正极反应式为2Na++FeS+2e-=Na2S+Fe,该电池在充电时,阳极发生反应的物质是________,放电时负极反应式为________。
的导电固体作为电解质,已知该电池正极反应式为2Na++FeS+2e-=Na2S+Fe,该电池在充电时,阳极发生反应的物质是________,放电时负极反应式为________。
【题目】从某含Br—废水中提取Br2的过程包括:过滤、氧化、萃取(需选择合适萃取剂)及蒸馏等步骤。已知:
物质 | Br2 | CCl4 | 正十二烷 |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
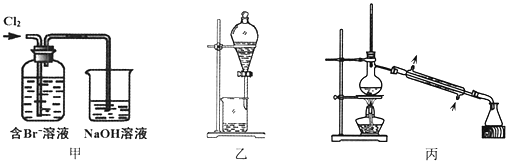
下列说法不正确的是
A. 甲装置中Br—发生的反应为:2Br-+ Cl2 = Br2 + 2Cl-
B. 甲装置中NaOH溶液每吸收0.1mol Cl2,转移0.1mol e—
C. 用乙装置进行萃取,溶解Br2的有机层在下层
D. 用丙装置进行蒸馏,先收集到的是Br2
【题目】氯化亚铜(![]() )在化工、印染、电镀等行业应用广泛。
)在化工、印染、电镀等行业应用广泛。![]() 微溶于水,不溶于醇和稀酸,可溶于
微溶于水,不溶于醇和稀酸,可溶于![]() 浓度较大的溶液,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量
浓度较大的溶液,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量![]() )为原料,采用硝酸铵氧化分解技术生产
)为原料,采用硝酸铵氧化分解技术生产![]() 的工艺过程如图。回答下列问题:
的工艺过程如图。回答下列问题:

(1)步骤①中N元素被还原为最低价,写出此反应的离子方程式______________。
(2)步骤②中,亚硫酸铵要略保持过量,原因是___________,滤液中可循环利用的物质是__________。
(3)步骤⑤中,用“醇洗”可快速去除滤渣表面的水,防止滤渣被空气氧化为![]() 被氧化为
被氧化为![]() 的化学方程式为______________________。
的化学方程式为______________________。
(4)用![]() 溶液测定氯化亚铜样品纯度(假设杂质不参与反应),步骤如下:准确称取所制备的氯化亚铜样品
溶液测定氯化亚铜样品纯度(假设杂质不参与反应),步骤如下:准确称取所制备的氯化亚铜样品![]() ,将其置于过量的
,将其置于过量的![]() 溶液中,待样品完全溶解后,加入适量稀硫酸配成
溶液中,待样品完全溶解后,加入适量稀硫酸配成![]() 溶液,取溶液
溶液,取溶液![]() 用
用![]() 溶液进行滴定,反应中
溶液进行滴定,反应中![]() 被还原成
被还原成![]() ,相关数据记录如表所示:该样品中
,相关数据记录如表所示:该样品中![]() 的质量分数__________________。
的质量分数__________________。
实验编号 | 1 | 2 | 3 |
消耗 | 14.98 | 16.03 | 15.02 |
(5)制造印刷电路板产生的废液中含大量![]() 等离子,利用膜电解技术对此废液进行电解,电解装置如图所示。电解后的阴极液中加入适量盐酸并用水稀释可得到
等离子,利用膜电解技术对此废液进行电解,电解装置如图所示。电解后的阴极液中加入适量盐酸并用水稀释可得到![]() ,电解时阴极的电极反应式为___________,生成
,电解时阴极的电极反应式为___________,生成![]() 的离子方程式为________________________________。
的离子方程式为________________________________。