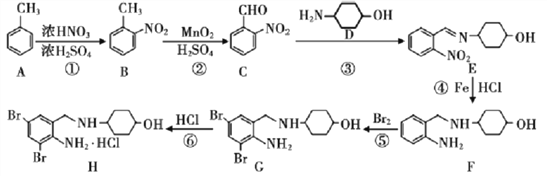
题目内容
【题目】氨基甲酸铵(H2NCOONH4)是一种易分解、易水解的白色固体,易溶于水,难溶于CCl4,某研究小组用如图1所示的实验装置制备氨基甲酸铵。
反应原理:2NH3(g)+CO2(g)![]() NH2COONH4(s) △H<0。
NH2COONH4(s) △H<0。

(1)仪器2的名称是__。仪器3中NaOH固体的作用是__。
(2)①打开阀门K,仪器4中由固体药品所产生的气体就立即进入仪器5,则该固体药品的名称为__。
②仪器6的一个作用是控制原料气按反应计量系数充分反应,若反应初期观察到装置内稀硫酸溶液中产生气泡,应该__(填“加快”、“减慢”或“不改变”)产生氨气的流速。
(3)另有一种制备氨基甲酸铵的反应器(CCl4充当惰性介质)如图2:

①图2装置采用冰水浴的原因为__。
②当CCl4液体中产生较多晶体悬浮物时,即停止反应,__(填操作名称)得到粗产品。
为了将所得粗产品干燥可采取的方法是__。
A.蒸馏 B.高压加热烘干 C.真空微热烘干
(4)①已知氨基甲酸铵可完全水解为碳酸氢铵,则该反应的化学方程式为__。
②为测定某样品中氨基甲酸铵的质量分数,某研究小组用该样品进行实验。已知杂质不参与反应,请补充完整测定某样品中氨基甲酸铵质量分数的实验方案:用天平称取一定质量的样品,加水溶解,__,测量的数据取平均值进行计算(限选试剂:蒸馏水、澄清石灰水、Ba(OH)2溶液)。
【答案】三颈烧瓶 干燥氨气,防止生成的氨基甲酸铵水解 干冰 加快 降低温度,有利于提高反应物的转化率,防止因反应放热造成NH2COONH4分解 过滤 C NH2COONH4+2H2O=NH4HCO3+NH3H2O或NH2COONH4+H2O=NH4HCO3+NH3↑ 加入足量氢氧化钡溶液,充分反应后,过滤、用蒸馏水洗涤所得沉淀、干燥后称量沉淀的质量,重复2~3次
【解析】
根据装置:仪器2制备氨气,由于氨基甲酸铵易水解,所以用仪器3干燥氨气,利用仪器4制备干燥的二氧化碳气体,在仪器5中发生2NH3(g)+CO2(g)NH2COONH4(s)制备氨基甲酸铵;
(1)根据仪器构造可得;考虑氨基甲酸铵水解;
(2)①仪器4制备干燥的二氧化碳气体,为干冰;
②反应初期观察到装置内稀硫酸溶液中产生气泡,说明二氧化碳过量,氨气不足;
(3)①考虑温度对反应的影响和氨基甲酸铵受热分解;
②过滤得到产品,氨基甲酸铵易分解,所得粗产品干燥可真空微热烘干;
(4)①氨基甲酸铵可完全水解为碳酸氢铵和一水合氨,据此书写;
②测定某样品中氨基甲酸铵的质量分数,可以使其水解得到NH4HCO3,用氢氧化钡沉淀得到碳酸钡沉淀,通过碳酸钡的质量可得氨基甲酸铵的质量,进而可得其质量分数,据此可得。
(1)根据图示,仪器2的名称三颈烧瓶;仪器3中NaOH固体的作用是干燥氨气,防止生成的氨基甲酸铵水解;故答案为:三颈烧瓶;干燥氨气,防止生成的氨基甲酸铵水解;
(2)①反应需要氨气和二氧化碳,仪器2制备氨气,仪器4制备干燥的二氧化碳气体,立即产生干燥的二氧化碳气体,则为干冰;故答案为:干冰;
②氨气易溶于稀硫酸,二氧化碳难溶于稀硫酸,若反应初期观察到装置内稀硫酸溶液中产生气泡,说明二氧化碳过量,应该加快产生氨气的流速;故答案为:加快;
(3)①该反应为放热反应,温度升高不利于合成,故采用冰水浴可以降低温度,有利于提高反应物的转化率,防止因反应放热造成H2NCOONH4分解;故答案为:降低温度,有利于提高反应物的转化率,防止因反应放热造成H2NCOONH4分解;
②当CCl4液体中产生较多晶体悬浮物时,即停止反应,过滤,为防止H2NCOONH4分解,真空微热烘干粗产品;故答案为:过滤;C;
(4)①氨基甲酸铵可完全水解为碳酸氢铵,反应为:NH2COONH4+2H2O=NH4HCO3+NH3H2O或NH2COONH4+H2O=NH4HCO3+NH3↑;故答案为:NH2COONH4+2H2O=NH4HCO3+NH3H2O或NH2COONH4+H2O=NH4HCO3+NH3↑;
②测定某样品中氨基甲酸铵的质量分数,可以使其水解得到NH4HCO3,用氢氧化钡沉淀得到碳酸钡沉淀,通过碳酸钡的质量可得氨基甲酸铵的质量,进而可得其质量分数,具体方法为:用天平称取一定质量的样品,加水溶解,加入足量氢氧化钡溶液,充分反应后,过滤、用蒸馏水洗涤所得沉淀、干燥后称量沉淀的质量,重复2~3次,测量的数据取平均值进行计算;故答案为:加入足量氢氧化钡溶液,充分反应后,过滤、用蒸馏水洗涤所得沉淀、干燥后称量沉淀的质量,重复2~3次。