题目内容
【题目】(1)室温下,在0.5 mol/L的纯碱溶液中加入少量水,由水电离出的c(H+)·c(OH-)_______ (填“变大”、“变小”、“不变”)。
(2)已知Ksp(Ag2CrO4)=1.0×10-12,向0.2 moL的AgNO3溶液中加入等体积的0.08 mol/L K2CrO4溶液,则溶液中的c(CrO42-)=________。
(3)室温下,0.1 mol/L NaHCO3溶液的pH值________0.1 mol/LNa2SO3溶液的pH值(填“>”、“<”、“=”)。
已知:
酸 | 电离平衡常数 | |
H2CO3 | K1=4.3×10-7 | K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 | K2=1.02×10-7 |
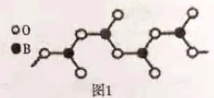
(4)有一种可充电电池Na—Al/FeS,电池工作时Na+的物质的量保持不变,并且是用含![]() 的导电固体作为电解质,已知该电池正极反应式为2Na++FeS+2e-=Na2S+Fe,该电池在充电时,阳极发生反应的物质是________,放电时负极反应式为________。
的导电固体作为电解质,已知该电池正极反应式为2Na++FeS+2e-=Na2S+Fe,该电池在充电时,阳极发生反应的物质是________,放电时负极反应式为________。
【答案】变小 2.5×10-9 mol/L < Na2S、Fe Na-e-=Na+
【解析】
(1)纯碱溶液中加入水稀释,促进碳酸根离子的水解,溶液中水电离出的氢氧根离子浓度减小,氢离子浓度减小,则由水电离出的c(H+)·c(OH-)变小;
(2)假设溶液的体积是V L,n(AgNO3)=0.2V mol,n(K2CrO4)=0.08V mol,AgNO3溶液与K2CrO4溶液等体积混合发生反应:2Ag++CrO42-=Ag2CrO4↓,可见反应后Ag+过量,其物质的量n(Ag+)过量=(0.2V-2×0.08V) mol=0.04V mol,则c(Ag+)过量=![]() =0.02 mol/L,由于Ksp(Ag2CrO4)=1.0×10-12,所以溶液中c(CrO42-)=
=0.02 mol/L,由于Ksp(Ag2CrO4)=1.0×10-12,所以溶液中c(CrO42-)= mol/L=2.5×10-9 mol/L;
mol/L=2.5×10-9 mol/L;
(3)根据酸的电离平衡常数大小可知:K1(H2CO3)>K2(H2SO3),根据盐的水解规律:有弱才水解,谁弱水水解,谁强显谁性,越弱越水解,可知等浓度的盐的水解程度:Na2SO3>NaHCO3,由于这两种盐都是强碱弱酸盐,水解显碱性,所以等浓度的盐溶液的碱性:Na2SO3>NaHCO3,则等浓度盐溶液的pH 关系为:NaHCO3<Na2SO3;
(4)在该装置的物质中,Na性质活泼,易失去电子而被氧化,为原电池的负极,负极的电极反应式为2Na-2e-=2Na+,又知该电池中正极的电极反应式为:2Na++FeS+2e-=Na2S+Fe,充电时,阳极发生氧化反应,电极方程式为Na2S+Fe-2e-=2Na++FeS,则阳极发生反应的物质是Na2S、Fe。

 阶梯计算系列答案
阶梯计算系列答案【题目】苯甲醛在医药、染料、香料等行业有着广泛的应用。实验室通过如图所示的流程由甲苯氧化制备苯甲醛。

试回答下列问题:
(1)Mn2O3氧化甲苯的反应需要不断搅拌,搅拌的作用是___。
(2)甲苯经氧化后得到的混合物通过结晶、过滤进行分离,该过程中需将混合物冷却,其目的___。
(3)实验过程中,可循环使用的物质分别为___,___。
(4)实验中分离甲苯和苯甲醛采用的操作I是___________。
(5)实验中发现,反应时间不同苯甲醛的产率也不同(数据见下表),
反应时间/h | 1 | 2 | 3 | 4 | 5 |
苯甲醛产率/% | 76.0 | 87.5 | 83.6 | 72.5 | 64.8 |
请结合苯甲醛的结构,分析当反应时间过长时,苯甲醛产率下降的原因___。