【题目】硫铁矿石(主要成分FeS2)用于工业制硫酸,其排出的矿渣在一定条件下以磁性氧化铁为主。经磁选获得精矿,可直接用于高炉炼铁。已知某精矿的主要成分是磁性氧化铁( Fe3O4)和Fe2O3及杂质(杂质不含铁、硫、氧元素,且杂质不耗氧)。请回答下列问题:
(1)某硫铁矿石中(杂质不含铁、硫)含硫的质量分数是0.360,则该硫铁矿石中含铁元素的质量分数是________(答案用小数表示,保留3位小数)。
(2)如用上述硫铁矿石制硫酸,矿渣经磁选获得精矿,直接用于高炉炼铁,当制得98.0%的硫酸1.92吨时(不考虑硫的损失),则炼铁厂(不计选矿及炼铁时铁的损耗)最多可生产含碳4.00%的生铁____吨(答案保留3位小数)。
(3)煅烧硫铁矿常用富氧空气。从沸腾炉排出的气体成分如下表。如果精矿中铁、氧的物质的量之比为n (Fe):n(O)=5:7,则富氧空气中O2和N2的体积比(最简单的整数比)为_________。
气体 | SO2 | N2 | O2 |
物质的量 | 10 | 58 | 6 |
(4)炼铁厂生产的生铁常用于炼钢。取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况下)。
①计算此钢样粉末中铁和碳的物质的量之比为________(最简单的整数比)。
②再取三份不同质量的上述钢样粉末分别加到100mL相同浓度的稀H2SO4中,充分反应后,测得的实验数据如下表所示:
实验序号 | I | II | III |
加入钢样粉末的质量(g) | 2.812 | 5.624 | 8.436 |
生成气体的体积(L)(标准状况) | 1.120 | 2.240 | 2.800 |
则该硫酸溶液的物质的量浓度为________________。
③若在上述实验II中继续加入m g钢样粉末,计算反应结束后剩余的固体质量为多少?(写出必要的步骤,答案保留3位小数)_______________。
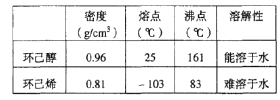
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯。
已知: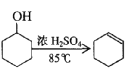 +H2O
+H2O
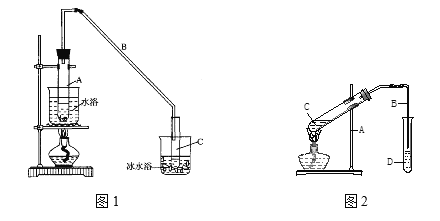
(1)如图1是实验室制取乙酸乙酯的装置。则下列说法不正确的是(____)
A.右边导管不插入饱和碳酸钠溶液
B.试管D中油状物在下层,饱和碳酸钠溶液主要为了中和挥发出的乙酸
C.试管C中加入试剂的顺序是:2mL浓硫酸→3mL乙醇→2mL冰醋酸
D.反应结束后试管C液体可能会变黑色
(2)在制取乙酸乙酯的过程中,用浓硫酸作为催化剂有缺点,不能重复使用,而且副反应较多。目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)。
同一反应时间 | 同一反应温度 | ||||
反应温度/℃ | 转化率(%) | 选择性(%)* | 反应时间/h | 转化率(%) | 选择性(%)* |
40 | 77.8 | 100 | 2 | 80.2 | 100 |
60 | 92.3 | 100 | 3 | 87.8 | 100 |
80 | 92.6 | 100 | 4 | 92.3 | 100 |
120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
选择性100%表示反应生成的产物是乙酸乙酯和水 | |||||
根据表中数据,下列________(填字母)为该反应的最佳条件。
A.120℃,4h B.80℃,6h C. 60℃,4h D.80℃,4h
(3)制备环己烯粗品(装置如图2)
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是____________。
②试管C置于冰水浴中的目的是_____________。
(4)制备环己烯精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),放液时,若发现液体流不出来,其可能原因除分液漏斗活塞堵塞外,还有________;分液后用_________ (填入编号)洗涤;
a.NaHSO4溶液 b.Na2CO3溶液 c.稀H2SO4 d.溴水
在此制备过程中,加入饱和食盐水的作用是__________________。
②对分离出来的环己烯再进行蒸馏得到环己烯精品,为了区分环己烯精品和粗品,某个小组设计了以下几种方法,合理的是_________。
a.用酸性高锰酸钾溶液 b.用金属K c.用Na2CO3溶液 d.用NaOH溶液
【题目】一定条件下,向2L恒容密闭容器中充入1mol PCl5,发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)反应过程中测定的部分数据见表(反应过程中条件不变);
PCl3(g)+Cl2(g)反应过程中测定的部分数据见表(反应过程中条件不变);
t/s | 0 | 60 | 150 | 250 | 350 | 450 |
n(PCl3)/mol | 0 | 0.12 | 0.19 | 0.2 | 0.2 | x |
请回答下列问题:
(1)x的值是___。
(2)0~60s内,用PCl3的浓度变化表示的化学反应速率是__。
(3)60s时,PCl5的转化率是__。
(4)达平衡时,容器中Cl2的体积分数是__(结果保留一位小数),由表中数据计算此条件下,该反应的平衡常数是__mol·L-1。
【题目】某课外活动小组拟探究H+浓度对MnO2与H2O2反应速率的影响。现取等量MnO2和下表有关物质,在相同温度下进行4组实验,分别记录收集20.0mL氧气所需时间。
实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
10%H2O2的体积/mL | 5.0 | 5.0 | V1 | V2 |
20%硫酸的体积/mL | 0 | 0.5 | 1.0 | V3 |
水的体积/mL | 15 | 14.5 | V4 | 13.5 |
所需时间t/s | t1 | t2 | t3 | t4 |
已知酸性条件下时:MnO2+H2O2+2H+=Mn2++O2↑+2H2O
(1)实验Ⅰ发生反应的化学方程式为__,实验Ⅱ中MnO2的作用是__。
(2)上表中V1=__mL,V3=___mL。
(3)若实验测得t2>t3>t4,则可得出的实验结论是___。